Los estados hipercoagulables (también denominados trombofilias) son un grupo de enfermedades hematológicas que se definen por un mayor riesgo de formación de coágulos (i.e., trombosis) debido a un aumento de los procoagulantes, a una disminución de los anticoagulantes o a un descenso de la fibrinólisis. Existen causas hereditarias y adquiridas, siendo el factor V Leiden la causa hereditaria más común. Clínicamente, los estados de hipercoagulabilidad se presentan con eventos trombóticos, que causan la oclusión de los vasos y pueden provocar daños en los órganos. Los trastornos trombóticos pueden ser mortales si no se tratan, y el tratamiento suele incluir anticoagulantes.
Última actualización: Mar 24, 2025
La hipercoagulabilidad, también denominada trombofilia, se refiere a la mayor tendencia de la sangre a formar coágulos, conocidos como trombos. Los estados hipercoagulables pueden ser hereditarios o adquiridos.
Prevalencia de las trombofilias hereditarias:
| Afección | Prevalencia | Riesgo de TEV |
|---|---|---|
| Factor V Leiden | 3%–7% | 4,3% |
| Mutación G20210A de la protrombina | 1%–3% | 1,9% |
| Deficiencia de proteína C (heterocigoto) | 0,02%–0,05% | 11,3% |
| Deficiencia de proteína S (heterocigoto) | 0,01% | 32,4% |
| Deficiencia de antitrombina | 0,02%–0,04% | 17,5% |
Estados hipercoagulables adquiridos más comunes:
Impacto clínico:
Los eventos trombóticos se producen en 3 condiciones principales, que constituyen la tríada de Virchow. Estas 3 condiciones son:
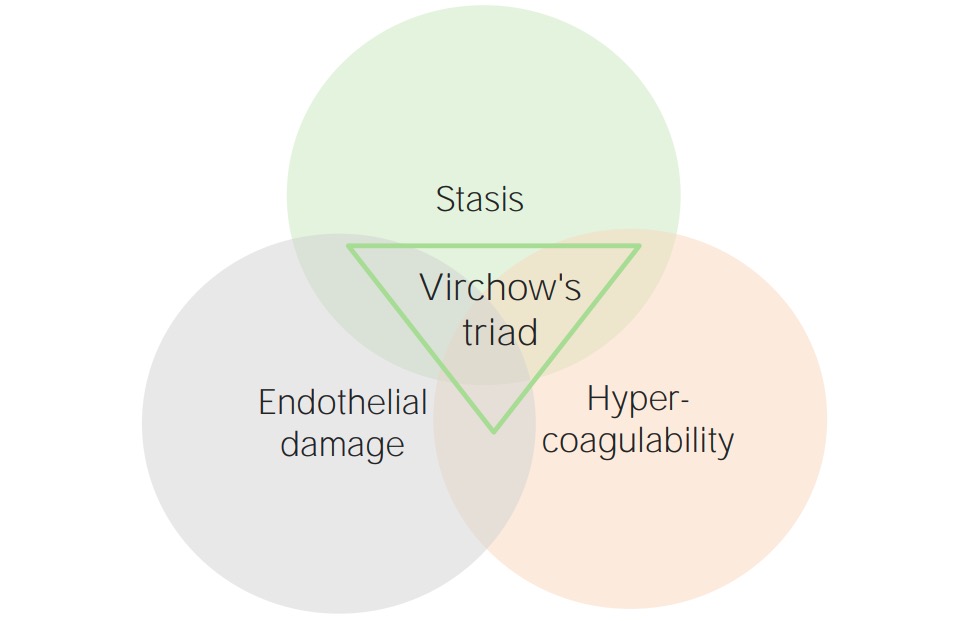
Tríada de Virchow
Imagen por Lecturio.Los estados hipercoagulables pueden ser primarios (hereditarios) o secundarios (adquiridos).
| Afección | Patrón de herencia | Fisiopatología |
|---|---|---|
| Factor V Leiden | Autosómico dominante con penetrancia incompleta |
|
| Protrombina G20210A (también conocida como mutación del factor II) | Autosómico dominante |
|
| Deficiencia de antitrombina | Autosómico dominante |
|
| Deficiencia de proteína C o S | Autosómico dominante (raro; puede ser recesivo) |
|
| Síndrome de plaquetas pegajosas | Autosómico dominante |
|
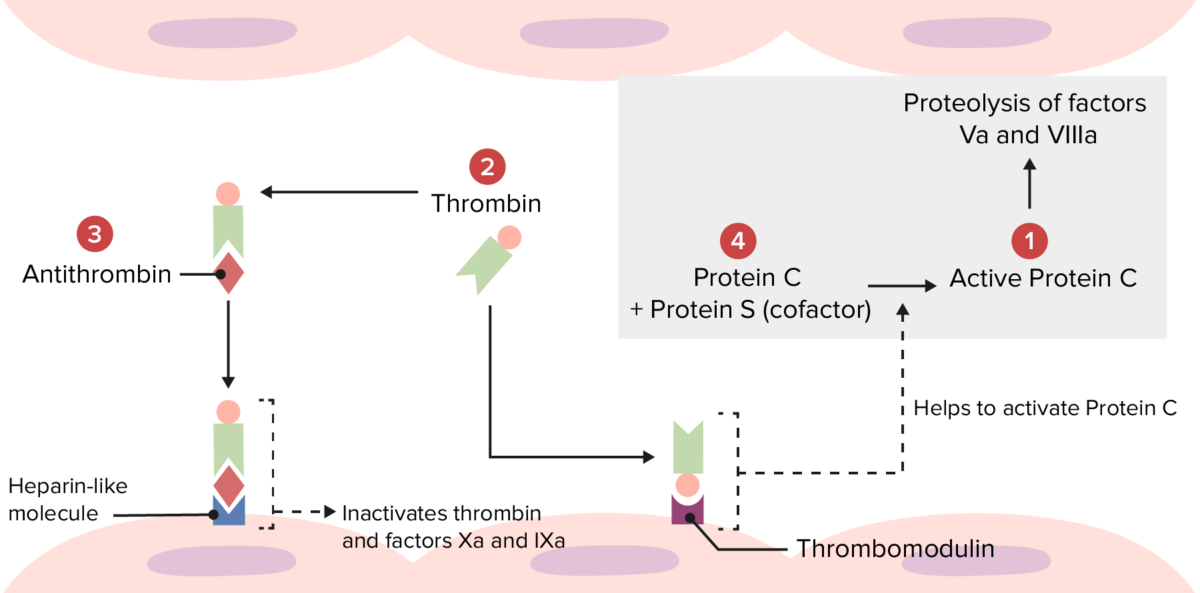
Descripción general de la vía trombolítica fisiológica:
Varios trastornos hipercoagulables se producen debido a anomalías en las siguientes localizaciones.
Mutaciones en 1: El factor V Leiden hace que el factor Va sea resistente a la degradación por la proteína C activada.
Mutaciones en 2: La mutación de la protrombina produce un aumento de la cantidad de protrombina, lo que lleva a la formación en exceso de trombina.
Mutaciones en 3: La deficiencia de antitrombina provoca una menor inactivación de la trombina y de los factores Xa y IXa.
Mutaciones en el 4: La deficiencia de la proteína C o S conduce a una menor inactivación de los factores Va y VIIIa.
Muchas otras afecciones y estados aumentan el riesgo trombótico al afectar a los componentes de la tríada de Virchow (normalmente, estasis, lesión endotelial o ambas) de forma que favorecen la trombosis. Estas afecciones incluyen:
La presentación clínica primaria de un estado hipercoagulable será un evento trombótico o un familiar asintomático de un paciente con una condición hipercoagulable primaria conocida que se presenta para su evaluación.
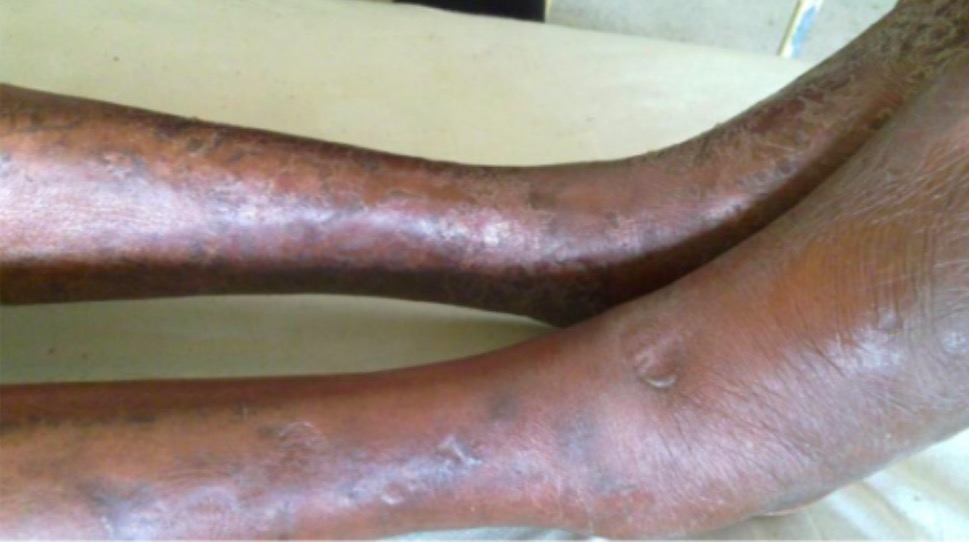
Edema con fóvea, con inflamación de la pierna derecha debido a una trombosis venosa profunda
Imagen: “Pitting oedema of right leg” por Department of medicine (ward 45), the National hospital of Sri Lanka, (Regent Street), Colombo, (00800), Sri Lanka. Licencia: CC BY 2.0Las mutaciones del factor V Leiden y de la protrombina G20210A no tienen ninguna presentación única más allá de los eventos trombóticos recurrentes. Se pueden observar varios hallazgos específicos en:
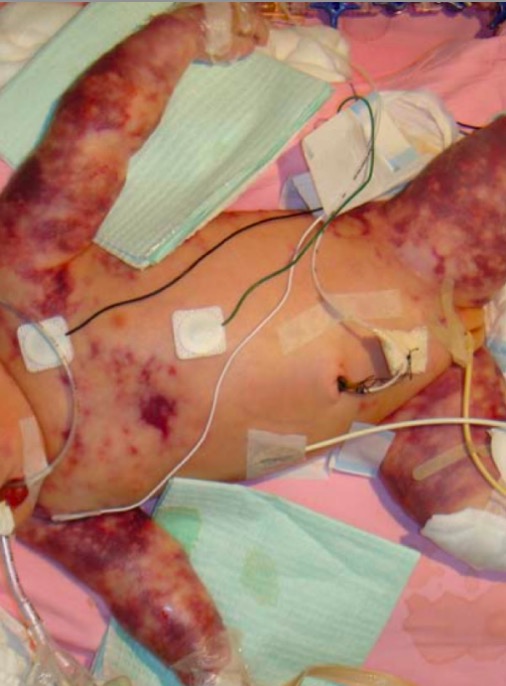
Púrpura fulminante neonatal
Imagen: “Purupura fulminans” por Department of Paediatrics, The Chinese University of Hong Kong, Prince of Wales Hospital, Shatin, Hong Kong. Licencia: CC BY 2.0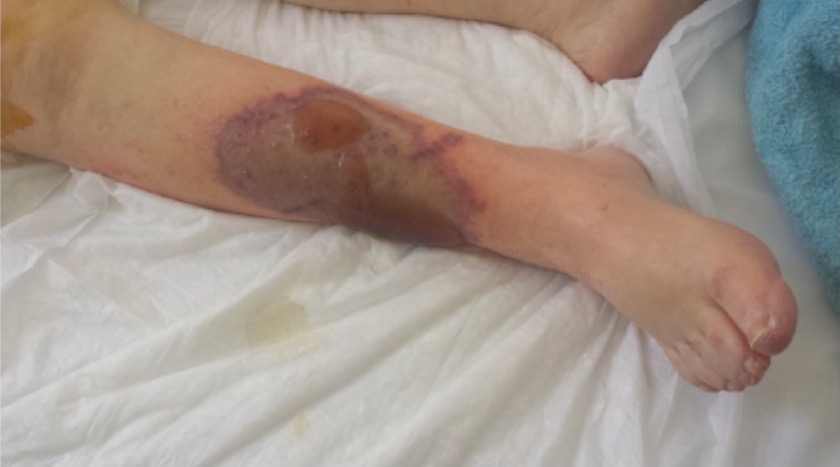
Necrosis cutánea inducida por la warfarina
Imagen: “Patient’s right leg” por 1st Department of Surgery, Vascular Surgery Unit, Laikon General Hospital, Medical School of Athens, Agiou Thoma 17, 11527 Athens, Greece. Licencia: CC BY 4.0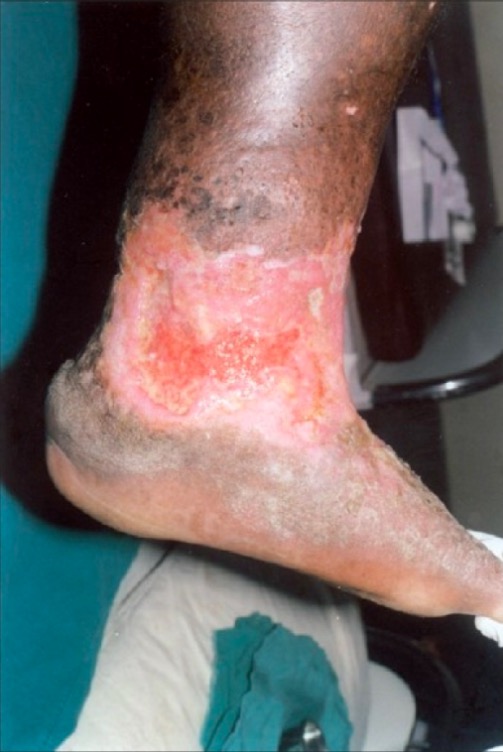
Úlcera por estasis venosa irregular, que no cicatriza, en la parte inferior de la pierna y el tobillo, con tejido de granulación poco saludable:
También hay lipodermatoesclerosis circundante, dermatitis por estasis y pigmentación ocre de la piel, todo ello característico de la insuficiencia venosa crónica.
Estos estudios deben realizarse en la mayoría de los pacientes con sospecha de eventos trombóticos.
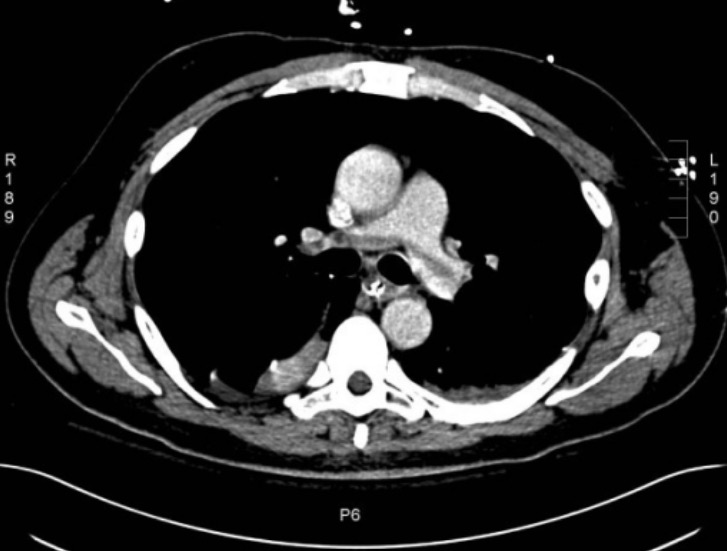
Angiograma por TC de tórax que muestra un émbolo pulmonar en silla de montar
Imagen: “Large saddle pulmonary embolism” por el Rhode Island Hospital, Brown University School of Medicine, 2 Dudley Street, Providence, RI, USA. Licencia: CC BY 2.0Considere la posibilidad de solicitar pruebas específicas adicionales para detectar una trombofilia hereditaria si los pacientes cumplen alguno de los siguientes criterios:
Si los pacientes cumplen alguno de los criterios anteriores para un estudio de trombofilia, se pueden solicitar las siguientes pruebas para detectar trombofilias hereditarias específicas:
Nota: La trombosis aguda y/o los anticoagulantes pueden reducir las concentraciones plasmáticas de antitrombina, proteína C y proteína S.
En pacientes con trombofilias hereditarias conocidas o que presentan factores de riesgo de trombosis:
La anticoagulación es el pilar del tratamiento de los eventos trombóticos. Las opciones para la anticoagulación inicial incluyen:
Duración de la terapia: