La esferocitosis hereditaria es el tipo más común de anemia hemolítica hereditaria. La afección está causada por una deficiencia proteica del citoesqueleto en la membrana de los eritrocitos. Esto da lugar a la pérdida de estabilidad de la membrana y a la deformabilidad de los eritrocitos, dando a la célula su forma esférica (esferocito). Estas células son susceptibles de degradación esplénica, lo que conduce a la hemólisis. El examen físico puede mostrar ictericia y esplenomegalia, mientras que las pruebas de laboratorio son consistentes con anemia hemolítica y aumento de la concentración de hemoglobina. Entre las múltiples pruebas de confirmación de la esferocitosis hereditaria, se prefiere la prueba de unión a eosina-5'-maleimida. El único tratamiento definitivo de la esferocitosis hereditaria es la esplenectomía.
Última actualización: May 26, 2025
En la esferocitosis hereditaria, las mutaciones genéticas conducen a la deficiencia de las proteínas del citoesqueleto:
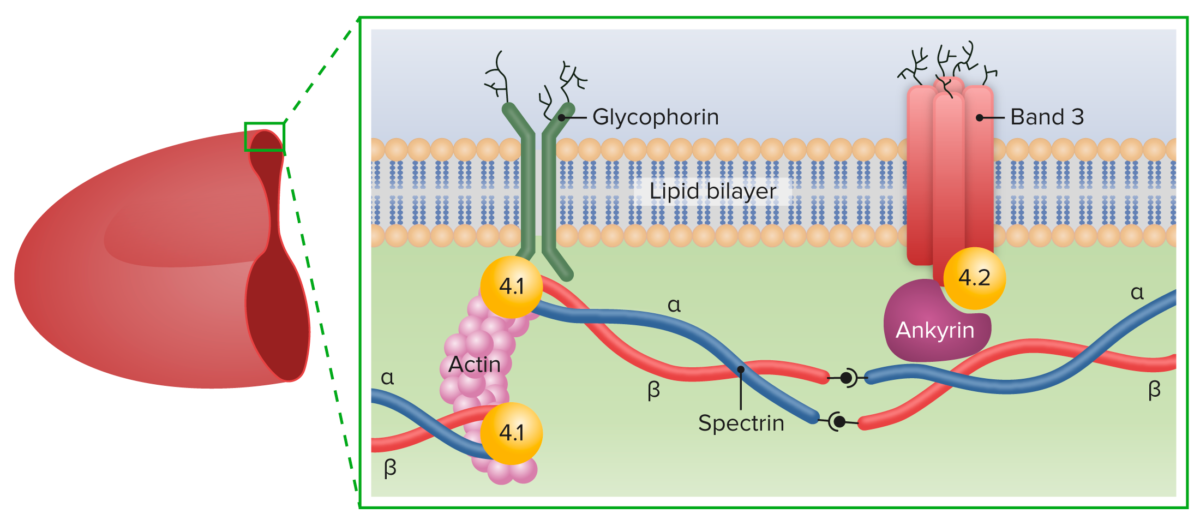
Principales proteínas de la membrana de los eritrocitos
Imagen por Lecturio.Se han establecido cuatro categorías clínicas basadas en la hemoglobina (Hb), el recuento de reticulocitos y el nivel de bilirrubina.
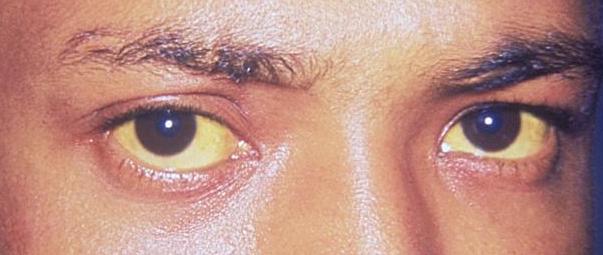
Ictericia escleral: El 1er signo clínico de depósito de bilirrubina en el organismo
Imagen: “Jaundice eye new” por CDC/Dr. Thomas F. Sellers/Emory University. Licencia: Dominio Público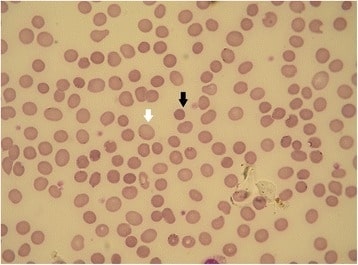
Esferocitosis hereditaria: frotis de sangre periférica
La flecha negra muestra un esferocito. La flecha blanca muestra un eritrocito normal (la falta de palidez central es un artefacto). Las formas de esferocitosis hereditaria que tienen diferentes defectos de membrana pueden mostrar diferentes morfologías de los eritrocitos.
El diagnóstico diferencial incluye otras causas de hemólisis, la mayoría de las cuales mostrarán al menos algunos esferocitos en la sangre periférica.