La deficiencia de piruvato quinasa (PK) es un trastorno enzimático autosómico recesivo de los eritrocitos que provoca anemia hemolítica. La deficiencia de PK es principalmente un trastorno hereditario, con un defecto en el gen PKLR o PKM, pero puede adquirirse de forma secundaria a afecciones subyacentes, como la leucemia. Las características clínicas típicas de la deficiencia de PK son anemia de leve a moderada, ictericia, retraso del crecimiento, retraso en el desarrollo y protuberancia frontal. Sin embargo, son posibles presentaciones más severas, especialmente en pacientes jóvenes. El diagnóstico implica descartar otras causas más frecuentes de anemia hemolítica. Las pruebas bioquímicas y/o genéticas pueden confirmar el diagnóstico. El manejo puede incluir tratamiento de soporte, mitapivat (un activador de PK recientemente aprobado por la FDA), exanguinotransfusión, fototerapia o esplenectomía. El pronóstico depende de la edad, asociándose una mayor edad en el momento del diagnóstico con un mejor pronóstico.
Última actualización: May 15, 2023
La deficiencia de piruvato quinasa (PK) es un trastorno enzimático autosómico recesivo de los eritrocitos que provoca hemólisis crónica debido a un defecto en el gen PKLR o PKM .
La piruvato quinasa es una enzima necesaria para la conversión de fosfoenolpiruvato (PEP, por sus siglas en inglés) en piruvato y ATP en la vía de la glucólisis, que produce energía.
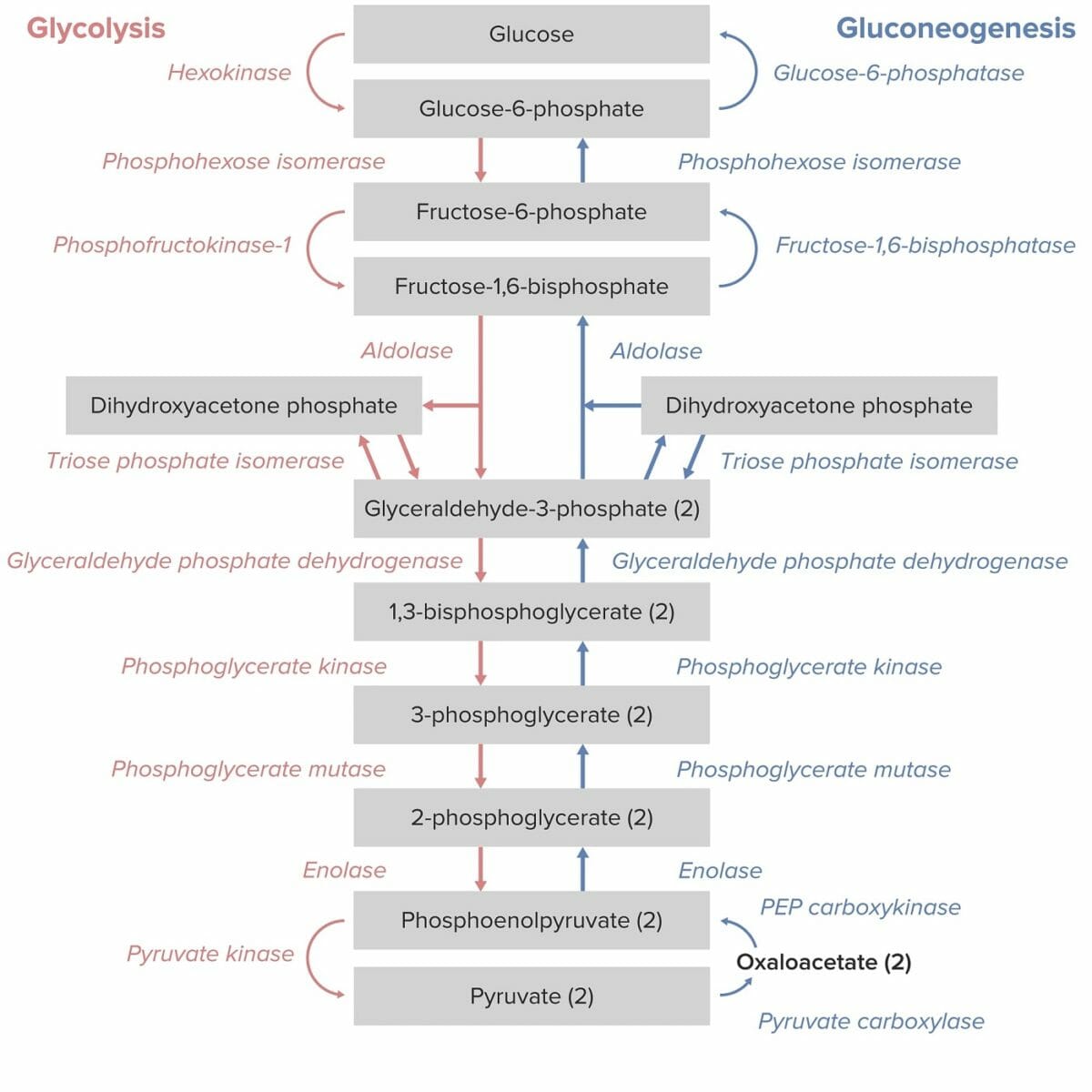
Vías de la glucólisis y la gluconeogénesis:
Obsérvese que la conversión de fosfoenolpiruvato en piruvato por la piruvato quinasa es el paso final de la vía de la glucólisis.
Efecto de la deficiencia de PK:
Consecuencias de la deficiencia de PK:
La edad y la severidad en el momento de la presentación dependen de la extensión de la hemólisis y la anemia. Además, la edad de presentación puede variar.
Signos y síntomas en recién nacidos:
Signos y síntomas en niños más grandes y adultos:
Niña de 6 semanas con síntomas de ictericia por hipotiroidismo.
Imagen: «Jaundice in the newborn» por el Dr. Hudson (CDC). Licencia: Dominio PúblicoLa deficiencia de piruvato quinasa es rara; es importante descartar otras causas de anemia hemolítica.
Hemograma completo con diferencial:
Química:
Pruebas de antiglobulina:
Frotis de sangre periférica, centrándose en la morfología de los eritrocitos:
El diagnóstico se confirma si un paciente con anemia hemolítica/hemólisis compensada presenta anomalías en las pruebas bioquímicas o genéticas.
Pruebas bioquímicas:
Pruebas genéticas:
Indicaciones de las pruebas genéticas:
El tratamiento depende de la edad en el momento del diagnóstico y de la severidad.
Se debe monitorear en los pacientes lo siguiente: