El daño celular isquémico es la lesión celular derivada de la reducción del flujo sanguíneo. El proceso implica hipoxia por interrupción del suministro de sangre, falta de nutrientes y acumulación de metabolitos tóxicos. El daño celular puede ser reversible (la función vuelve cuando el flujo sanguíneo se reanuda) o irreversible (cuando se ha pasado el umbral de reversibilidad). Aunque el flujo sanguíneo puede restablecerse y permitir la recuperación de las células, es posible que se produzcan lesiones por reperfusión en los tejidos previamente isquémicos. Al producir una sobrecarga de calcio, estrés oxidativo y mecanismos inflamatorios en los que intervienen las células inmunitarias, citoquinas y el sistema del complemento, la reperfusión también puede provocar la muerte celular (a menudo por necrosis). La susceptibilidad a la isquemia se ve afectada por diferentes factores, entre los que se encuentran la alta actividad metabólica, la presencia de circulación colateral, zonas limítrofes entre arterias y la magnitud de la isquemia. El órgano más susceptible a la isquemia es el cerebro. Otros órganos susceptibles son el corazón, riñones, hígado e intestino grueso.
Última actualización: Jul 17, 2022
La lesión celular isquémica es el daño derivado de la disminución del flujo sanguíneo, que provoca hipoxia, falta de nutrientes y acumulación de metabolitos tóxicos.
En las lesiones celulares, las células no pueden adaptarse o bien se supera la respuesta máxima de adaptación a los estímulos fisiológicos o patológicos.
La isquemia y la lesión por reperfusión son 2 causas de estímulos que conducen a lesión y muerte celular.
Otros estímulos perjudiciales son las causas físicas, como los traumatismos o la radiación, sustancias químicas, pérdida de nutrientes críticos y las mutaciones.
Etapas de la lesión y muerte celular:
Necrosis (causa más común):
Apoptosis (pequeño porcentaje):
Las células muertas son sustituidas por fosfolípidos y figuras de mielina, lo que da lugar a la clarificación o fagocitosis por parte de los macrófagos.
La lesión por isquemia puede deberse a:
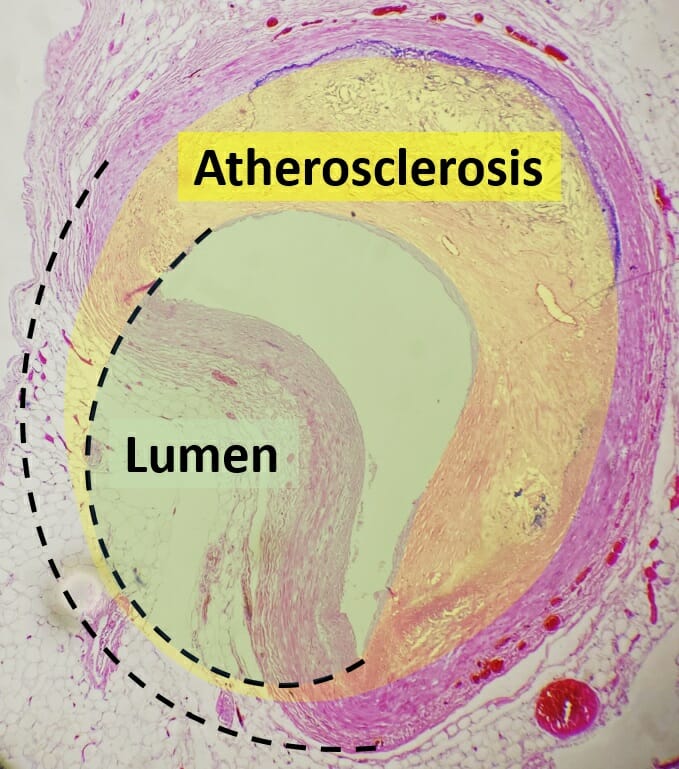
Histopatología de una arteria coronaria colapsada por aterosclerosis
Imagen: “Histopathology of coronary artery atherosclerosis, annotated” por Mikael Häggström. Licencia: CC0 1.0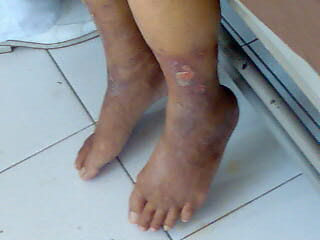
Úlceras en las extremidades causadas por la enfermedad venosa periférica
Imagen: “Peripheral Vascular Disease” por Wfnicdao. Licencia: Dominio PúblicoSe restablece la perfusión, lo que conlleva a vías nocivas:
La combinación de los mecanismos induce:
Se pierde la arquitectura celular y se produce la muerte celular.
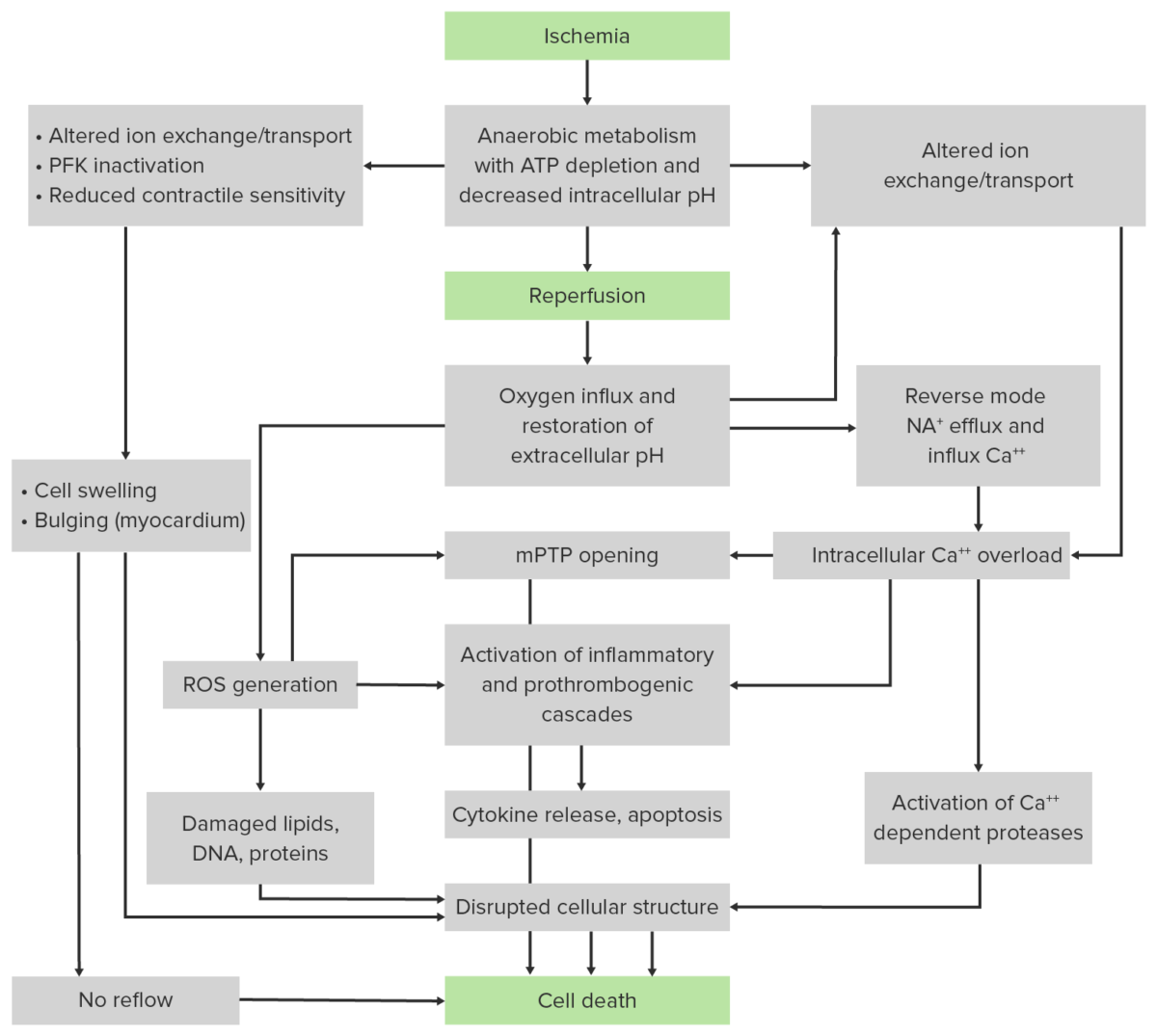
Diagrama de flujo que resume los principales acontecimientos patológicos que contribuyen a los componentes de isquemia (panel superior) y reperfusión (panel central) de la lesión tisular:
En la isquemia prolongada, la hipoxia conduce a un agotamiento del ATP y a una reducción del pH intracelular (por acumulación de lactato). Los mecanismos de transporte de iones dependientes del ATP se alteran, provocando una sobrecarga de calcio celular, edema/ruptura y muerte.
Cuando se restablecen los niveles de oxígeno (reperfusión), se generan especies reactivas de oxígeno (ROS). También se producen cambios proinflamatorios: Los neutrófilos se infiltran en los tejidos isquémicos y empeoran la lesión isquémica. Los acontecimientos patológicos conducen a la apertura del poro de transición de permeabilidad mitocondrial (mPTP) en la membrana mitocondrial interna, lo que permite el paso de moléculas al interior de la mitocondria y perjudica aún más la producción de ATP.
PFK: fosfofructoquinasa
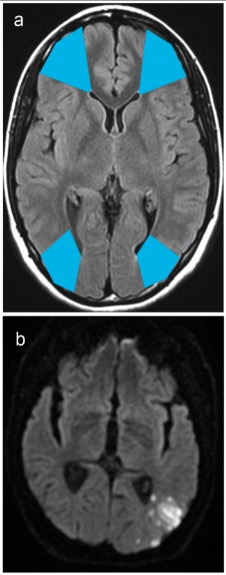
Zonas limítrofes e infartos observados en resonancia magnética (RM):
a: Las áreas limítrofes entre los territorios arteriales cerebrales anterior y medio se ven en el sombreado azul anterior.
Las áreas limítrofes entre los territorios arteriales medio y posterior se ven en el sombreado azul posterior.
b: El infarto de la zona limítrofe occipital se observa en los límites de los territorios arteriales medio y posterior.
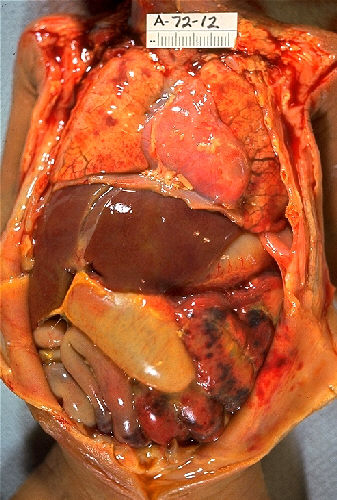
Enterocolitis necrotizante en un lactante:
Observe los parches de necrosis en el intestino.
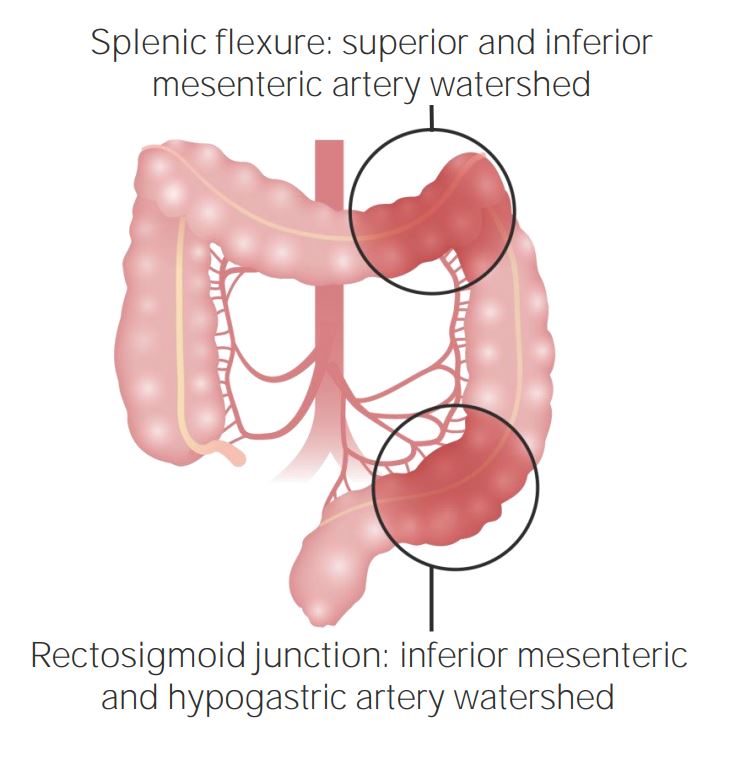
Zonas limítrofes del colon
Imagen por Lecturio.