Playlist
Show Playlist
Hide Playlist
Catalysis – Protein Functions
-
05 Basic ProteinFunctions.pdf
-
Biochemistry Free and Easy.pdf
-
Reference List Biochemistry.pdf
-
Download Lecture Overview
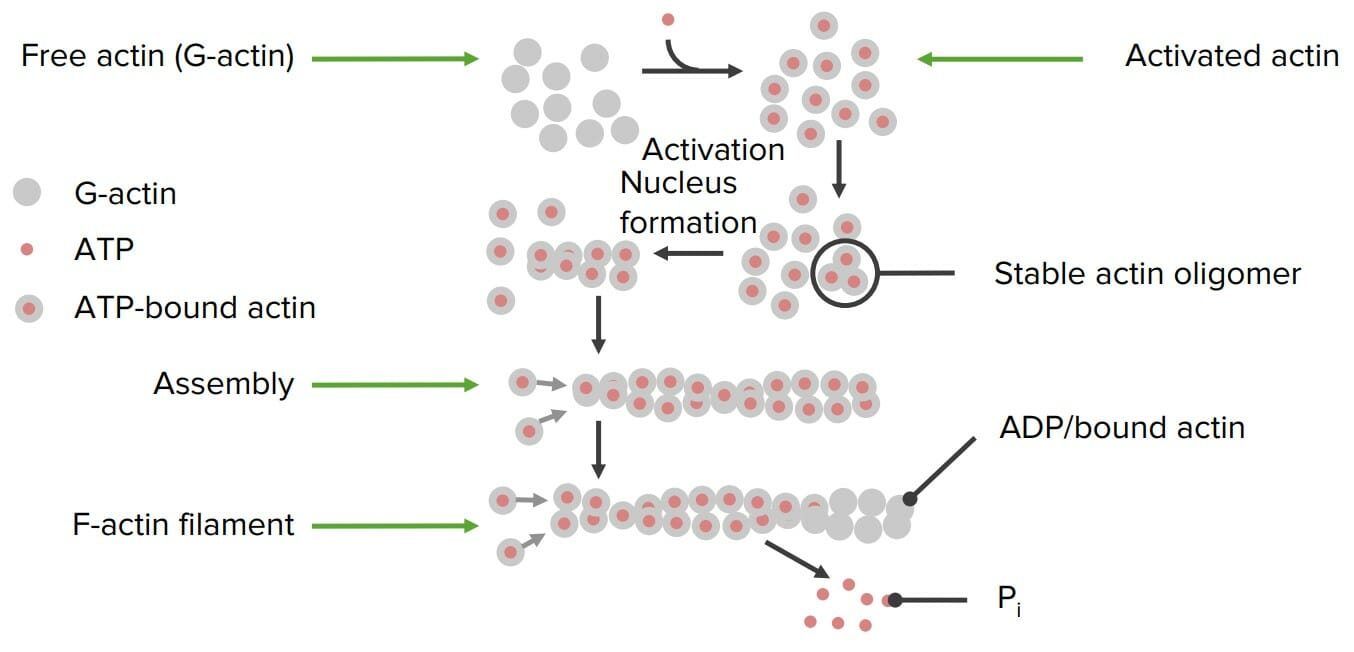
00:01 Eine weitere wichtige Funktion der Proteine und eine der bekanntesten Funktionen, die Proteine erfüllen, ist die des Katalysators von Reaktionen. Katalysatoren können Reaktionen natürlich um das Tausendfache beschleunigen, und wenn wir die Geschwindigkeit, mit der ein Katalysator, also ein chemischer Katalysator, arbeitet, mit einem biologischen Katalysator wie einem Enzym in einer Zelle vergleichen, ist der bemerkenswerte Unterschied bei der Katalyse verblüffend. Ein chemischer Katalysator kann beispielsweise eine Reaktion um das 10.000-fache beschleunigen, ein Enzym kann eine Reaktion um das 180.000.000-fache beschleunigen. 00:34 Das ist eine wirklich bemerkenswerte Sache, wenn man darüber nachdenkt. Wenn wir uns Enzyme als Katalysatoren vorstellen, erkennen wir, dass die Enzyme auf nanoskopischer Ebene einige bemerkenswerte Dinge tun, die in einer makroskopischen Welt, wie wir sie leben, anders sind und wirklich Sinn machen. 00:49 Dies ist teilweise in der Abbildung auf dem Bildschirm dargestellt. Nehmen wir zum Beispiel das Enzym Kohlensäureanhydrase. Die Kohlensäureanhydrase katalysiert eine Reaktion, bei der Kohlensäure in Wasser gebildet wird. Sie hat eine Umsatzzahl von etwa 700.000. 01:06 Was bedeutet das? Das bedeutet, dass dieses Enzym die Bildung von 700.000 Molekülen des Produkts pro Sekunde katalysiert. Das ist ein Molekül eines Enzyms. Es ist ziemlich schwer vorstellbar, dass in der makroskopischen Welt irgendetwas in einer Sekunde geschieht, geschweige denn 700.000 pro Sekunde. 01:24 Aber genau das tut die Kohlensäureanhydrase. Am unteren Ende der Skala sehen wir, dass Lysozym etwa alle zwei Sekunden eine Reaktion katalysiert, aber selbst das ist ziemlich bemerkenswert, wenn wir bedenken, was alles im katalytischen Prozess passiert. 01:40 Eine der Fragen, die man sich stellt, ist, wie kann ein Enzym etwas tun, das sich so sehr von dem unterscheidet, was ein chemischer Katalysator tut? Es gibt eine Reihe von Erklärungsversuchen. 01:50 Die populärste, die ursprünglich gelehrt wurde und auch heute noch vielerorts gelehrt wird, ist die des Fischer'schen Schlosses und Schlüssels. Mit dem Fischer'schen Schlüsselschloss lässt sich sehr gut erklären, wie Enzyme an ein Substrat binden. Es besagt, dass Enzyme eine Bindungsstelle haben, die dem Substrat ähnelt, und das Substrat bindet an diese Stelle. Und das ist so ziemlich alles, was das Fischer-Schloss-Schlüssel-Modell ausmacht, wie es funktioniert. Das Fischer-Schloss-Modell ist sehr gut geeignet, den Bindungsprozess zu erklären, aber es ist nicht sehr gut geeignet, den katalytischen Prozess zu erklären. Wie läuft er ab? Nun, ein neueres Modell, ein moderneres Modell oder eine moderne Perspektive ist die Koshland-induzierte Anpassung. 02:30 Die Koshland-induzierte Anpassung besagt, dass ein Enzym eine Stelle hat, an die sich das Substrat binden kann, aber es ist nur so ähnlich wie dieses Substrat, und Sie können in der Abbildung rechts sehen, dass die Bindungsstelle des Substrats für das Enzym nicht mit der Form des Substrats identisch ist. 02:43 Wenn das Substrat jedoch in die Bindungsstelle des Enzyms gelangt, ändert das Enzym seine Form und passt sich dem Substrat an, wie Sie auf der Folie sehen können, die sich nach unten bewegt. Diese Anpassung an das Substrat bedeutet nicht nur, dass das Enzym das Substrat verändert, sondern auch, dass das Substrat das Enzym vorübergehend verändert. 03:07 Und warum ist das so wichtig? Der Grund dafür ist, dass das Enzym seine Form verändert, um sich an das Substrat anzupassen, was bedeutet, dass innerhalb des Enzyms Spannungen oder Verzerrungen auftreten, die diesen ganzen Prozess erst möglich machen. Diese Spannungen im Enzym werden dann an das Substrat zurückgegeben und verursachen entweder mechanische oder elektronische oder andere Spannungen, die die Reaktion auslösen. Als Ergebnis dieser Veränderungen kann das Enzym eine Reaktion katalysieren, das Produkt kann freigesetzt werden und das Enzym kehrt in seinen ursprünglichen Zustand zurück. 03:42 Ich möchte das jetzt auf eine andere Weise veranschaulichen, und zwar mit einer Bindung des Substrats, wie wir hier sehen können. 03:48 In dieser Abbildung beginnen wir oben, mit dem grün dargestellten Enzym, das zwei Substrate hat. Wir können die beiden Substrate hier sehen, ein Molekül auf der linken Seite und ein Molekül auf der rechten Seite. Zu Beginn befindet sich das Enzym in einem ziemlich offenen Zustand, so ähnlich wie meine Hand. Im gebundenen Zustand hat das Enzym, wie Sie sehen können, seine Form verändert, ähnlich wie wenn Sie mir etwas in die Hand geben würden, meine Finger es umschließen würden, und genau das ist hier passiert. Genauso, wie wenn Sie etwas in meine Hand legen und meine Finger es umklammern würden, würde ich diese Gegenstände näher zusammenbringen und sie auf eine andere Weise zusammendrücken, als sie ursprünglich existierten. Durch das Zusammenfügen wird die Reaktion ausgelöst, d. h. der Stress, der durch die Bindung des Substrats ausgelöst wird, hat nun zu einer Situation geführt, in der das Enzym die Reaktion tatsächlich auslöst. 04:40 Wenn die Reaktion stattfindet, haben wir natürlich Moleküle, die als A und B beginnen, aber jetzt als C und D herauskommen, weil sie reagiert haben. Und wenn sie C und D sind, binden sie sich nicht mehr auf dieselbe Weise wie A und B. Was passiert dann? Das Enzym lässt los, und genau das passiert unten. Wir sehen also, dass das Enzym tatsächlich seine Form als Teil des katalytischen Prozesses ändert, und das ist sozusagen ein sehr magischer Teil von Enzymen.
About the Lecture
The lecture Catalysis – Protein Functions by Kevin Ahern, PhD is from the course Biochemistry: Basics.
Included Quiz Questions
What explains the difference between the Fisher lock and key model and Koshland induced fit model?
- The induced-fit model is a dynamic theory that suggests conformational changes occur during the binding process.
- The lock and key model is a dynamic theory that suggests conformational changes occur during the binding process.
- The induced-fit model suggests atrophy favors enzyme and substrate interaction.
- The lock and key model suggests the protein substrate is a dynamic molecule.
- The induced-fit model suggests a strict ATP requirement for enzyme and substrate interaction.
Which of the following enzymes, in the human body, act at the fastest rate?
- Carbonic anhydrase
- Acetylcholinesterase
- Fumarase
- Lysozyme
- DNA Polymerase I
What is the turnover number of an enzyme?
- The maximum number of chemical conversions of the substrate molecules executed by an enzyme per second (at a given enzyme concentration).
- The minimum number of chemical conversions of the substrate molecules executed by an enzyme per second (at a given enzyme concentration).
- The minimum number of chemical conversions of the substrate molecules executed by an enzyme per minute (at a given enzyme concentration).
- The maximum number of chemical conversions of the substrate molecules executed by an enzyme per hour (at a given enzyme concentration).
- The maximum number of chemical conversions of the substrate molecules executed by an enzyme per minute (at a given enzyme concentration).
Customer reviews
5,0 of 5 stars
| 5 Stars |
|
1 |
| 4 Stars |
|
0 |
| 3 Stars |
|
0 |
| 2 Stars |
|
0 |
| 1 Star |
|
0 |
i like this lecture. way of representing and explaining is quiet good.