El trasplante de órganos es un procedimiento que implica la extracción de un órgano o tejido vivo y su traslado a una parte diferente del cuerpo o en una persona diferente. Los trasplantes de órganos se han convertido en la opción terapéutica de elección para muchas personas con insuficiencia orgánica terminal. El trasplante puede ofrecer al individuo un tratamiento definitivo para una determinada entidad patológica. En los últimos 50 años, el trasplante de órganos se ha convertido en una práctica exitosa y en evolución que beneficia a más de 100 000 personas al año en todo el mundo. Tanto los órganos sólidos como las células hematopoyéticas derivadas de la médula ósea se pueden trasplantar con éxito para varias indicaciones diferentes. La tolerancia del órgano trasplantado por parte del sistema inmunitario del huésped se logra mediante el uso de estrategias inmunosupresoras e inmunomoduladoras. Las principales complicaciones del trasplante son el rechazo de órganos o fallo del injerto; sin embargo, la inmunosupresión crónica también conlleva el riesgo de complicaciones graves, incluidas infecciones potencialmente mortales.
Última actualización: Dic 5, 2024
El tejido trasplantado puede ser células (e.g., células madre hematopoyéticas), tejidos (e.g., córnea), partes de un órgano (e.g., injertos de hígado y piel) u órganos completos (e.g., riñón, corazón). Hay muchos términos que son importantes para la medicina de trasplantes.
La compatibilidad inmunológica entre un donante de órganos y un receptor de órganos es importante para mejorar el éxito de un trasplante y reducir el riesgo de rechazo. La tipificación del antígeno leucocitario humano (HLA, por sus siglas en inglés) del tejido es fundamental para el trasplante de células madre hematopoyéticas y órganos sólidos, incluidos trasplantes de riñón, corazón, hígado, páncreas y pulmón.
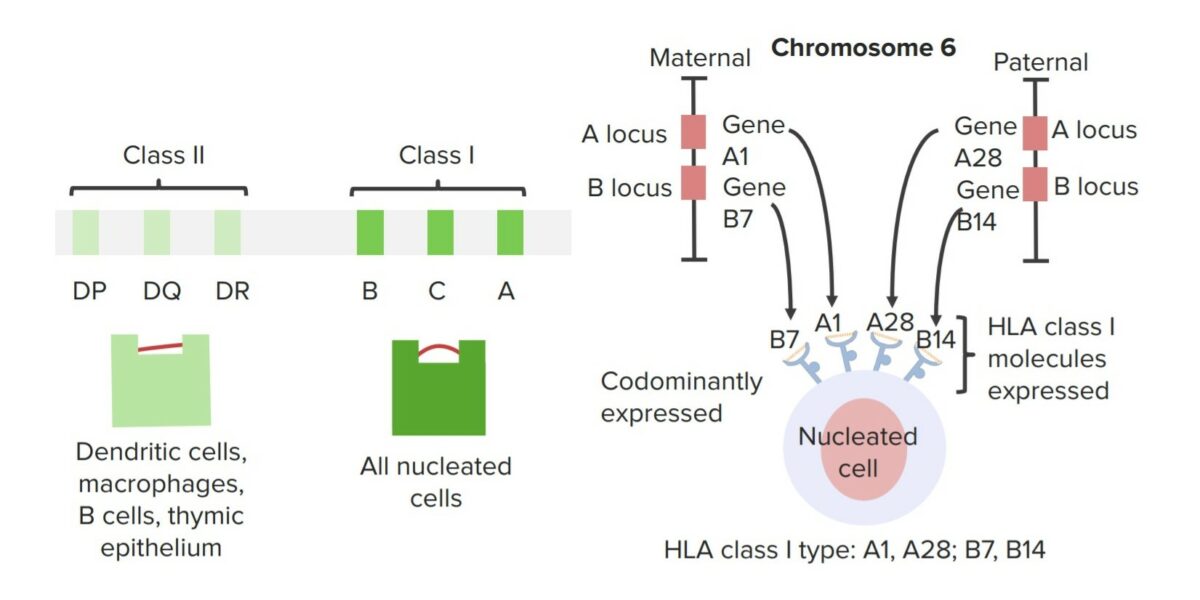
Complejo mayor de histocompatibilidad
Imagen por Lecturio.El rechazo puede ser agudo o crónico, y los síntomas varían según el sistema.
| Rechazo | Tiempo después del trasplante | Características del rechazo |
|---|---|---|
| Hiperagudo | Dentro de 48 horas |
|
| Acelerado | 3–5 días |
|
| Agudo | > 5 días |
|
| Crónica | Meses a años |
|
Los receptores de trasplantes de órganos sólidos deben tomar medicamentos inmunosupresores para evitar el rechazo del injerto. Los medicamentos inmunosupresores actuales tienen como objetivo la activación de los linfocitos T y la producción de citoquinas, la expansión clonal de los linfocitos T o ambas.
La escasez de órganos de donantes es un factor importante en el trasplante hepático; muchas personas fallecen mientras esperan un órgano. Ahora se utilizan trasplantes de donantes vivos, en los que solo se extrae una parte del hígado de un donante sano.
Complicaciones:
Complicaciones de la inmunosupresión:
Inmunización para personas postrasplantadas/inmunosuprimidas:
Rechazo:
Otras complicaciones:
Se puede ofrecer un trasplante cardíaco a personas que tienen síntomas intolerables a pesar de la terapia médica óptima y que corren el riesgo de morir debido a una enfermedad cardíaca.