La regulación epigenética es la regulación de la expresión génica que no implica alteraciones en la secuencia de ácido desoxirribonucleico (ADN) ni en ninguno de sus productos transcritos. Las formas más comunes de regulación epigenética son la metilación del ADN, que suprime la expresión génica, y las modificaciones de las proteínas histonas, que afectan la estructura del empaquetamiento del ADN. Las modificaciones epigenéticas son responsables de las afecciones relacionadas con la impronta, incluidos los síndromes de Prader–Willi y Angelman.
Última actualización: Abr 25, 2025
La modificación epigenética es una modificación al ADN o al empaquetamiento del ADN que afecta la expresión génica sin alterar el código genético (i.e., secuencia del ADN) en sí.
Estas modificaciones:
La unidad básica del empaquetamiento del ADN es el nucleosoma. El ADN se envuelve 2¼ veces alrededor de un núcleo de 8 proteínas histonas, formando un nucleosoma.
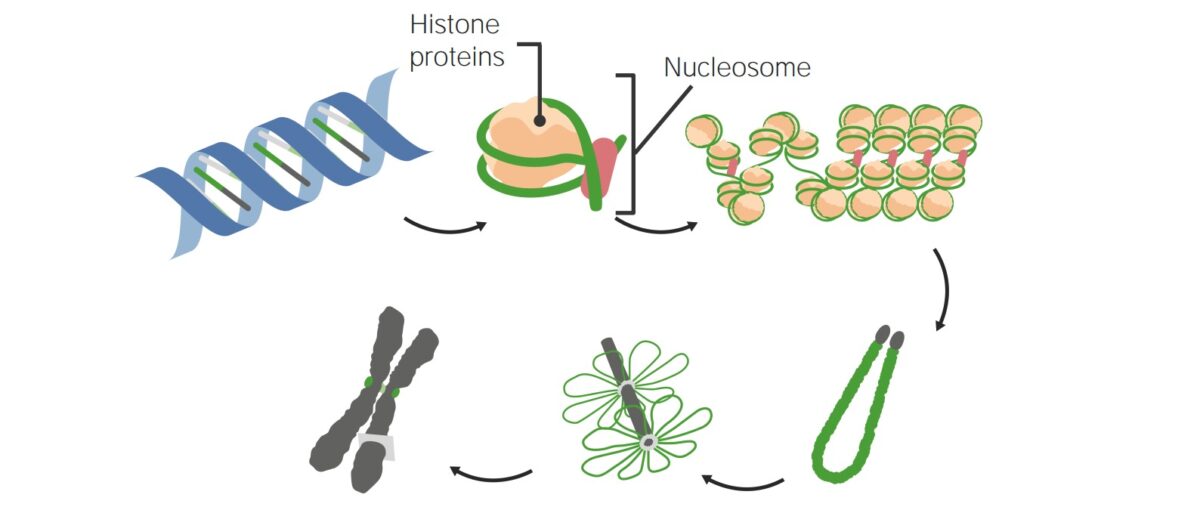
Cómo se empaqueta el ADN en los nucleosomas y luego en los cromosomas
Imagen por Lecturio.Las formas más importantes de modificación epigenética incluyen la metilación directa del ADN, modificaciones de las proteínas histonas y otras modificaciones de la cromatina.
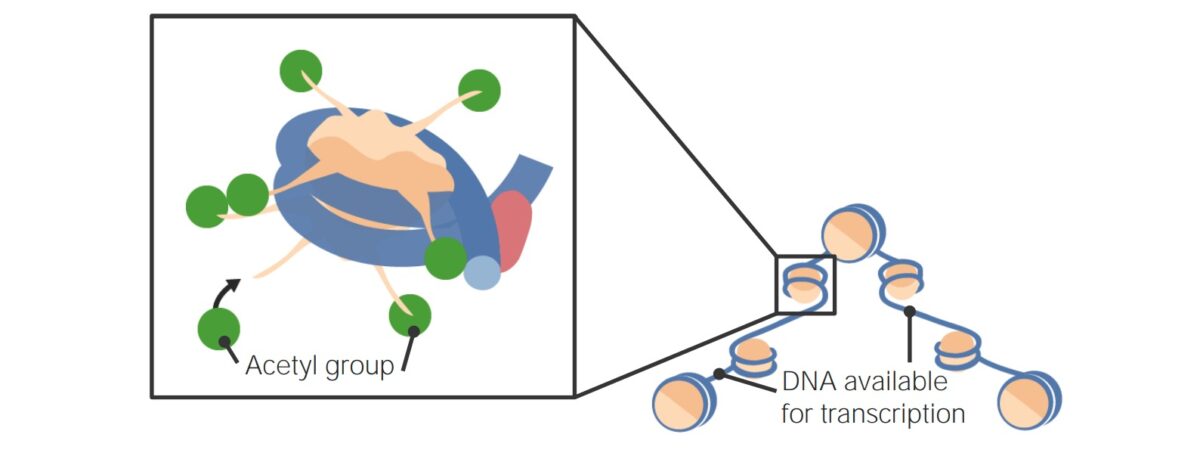
Acetilación de histonas
Imagen por Lecturio.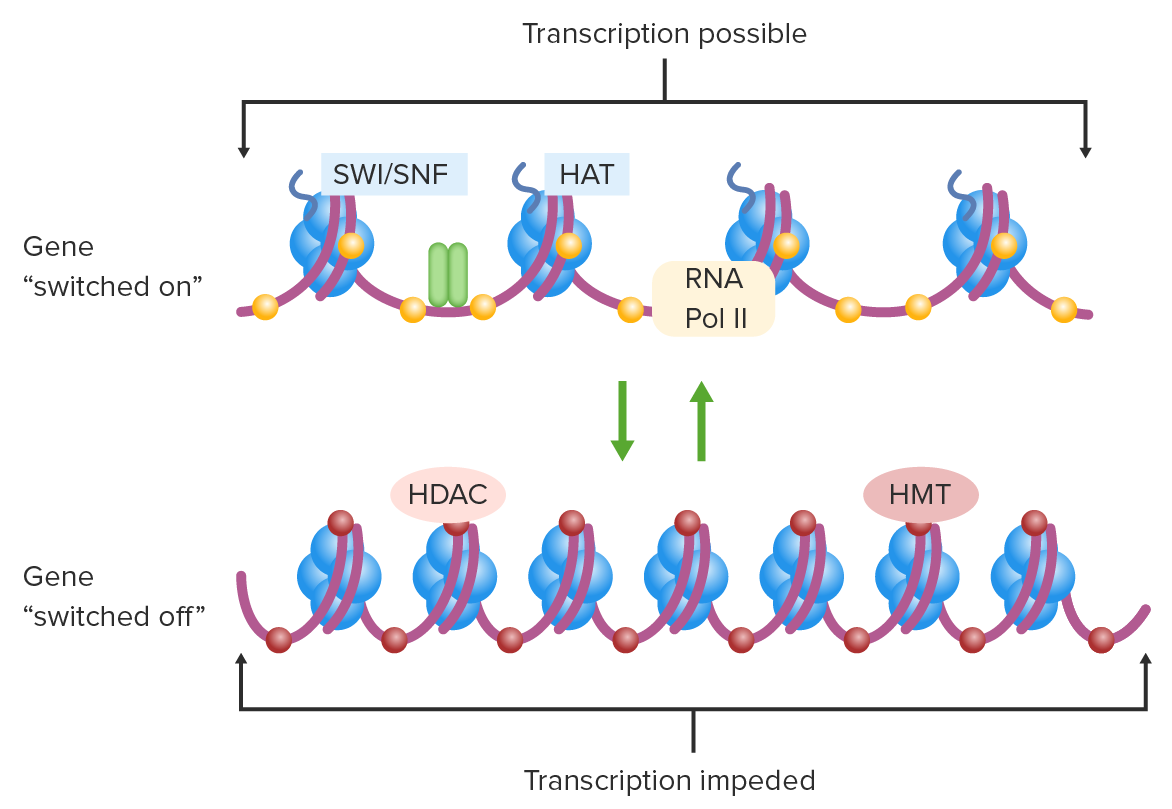
Regulación de la transcripción por modificaciones epigenéticas:
Gen activado: cromatina abierta, citosinas no metiladas, histonas acetiladas.
Gen apagado: cromatina condensada, citosinas metiladas, histonas desacetiladas.
HAT: histona acetiltransferasa
HDAC: histona desacetilasa
HMT: histona metiltransferasa
Pol II: polimerasa II
SWI/SNF: complejo switch/sacarosa no fermentable
Remodelar la cromatina y/o los nucleosomas es otra forma en que la célula puede regular la expresión génica a nivel epigenético. La remodelación de la cromatina generalmente requiere energía. Los tipos de remodelación de la cromatina incluyen:
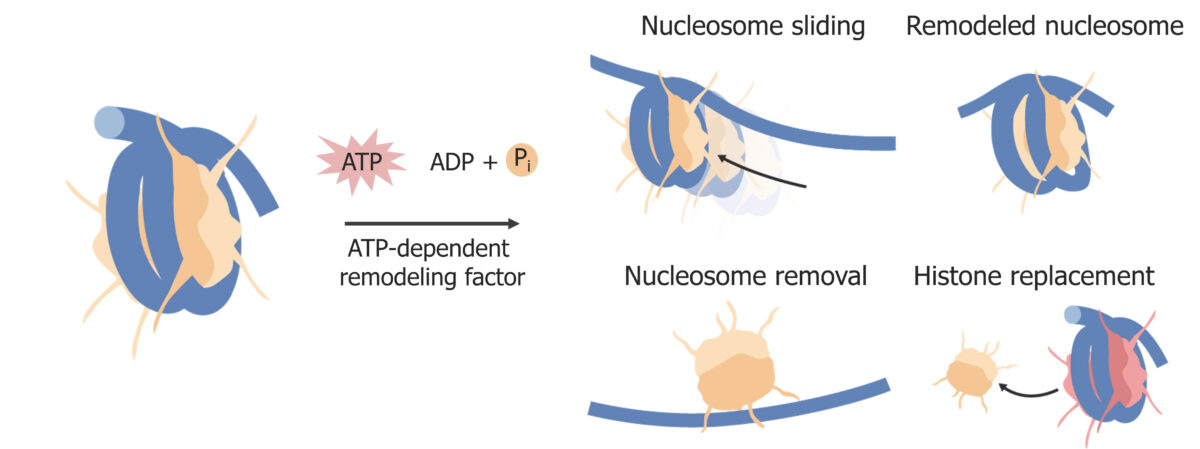
Remodelación de nucleosomas:
Ejemplos de cambios en las histonas. Los factores de remodelación de la cromatina también alteran la estructura de la cromatina. La cromatina usa energía del adenosin trifosfato (ATP, por sus siglas en inglés).
La impronta comprende las modificaciones epigenéticas específicas que ocurren en los gametos específicos del sexo (i.e., las modificaciones ocurren solo en los espermatozoides o los óvulos).
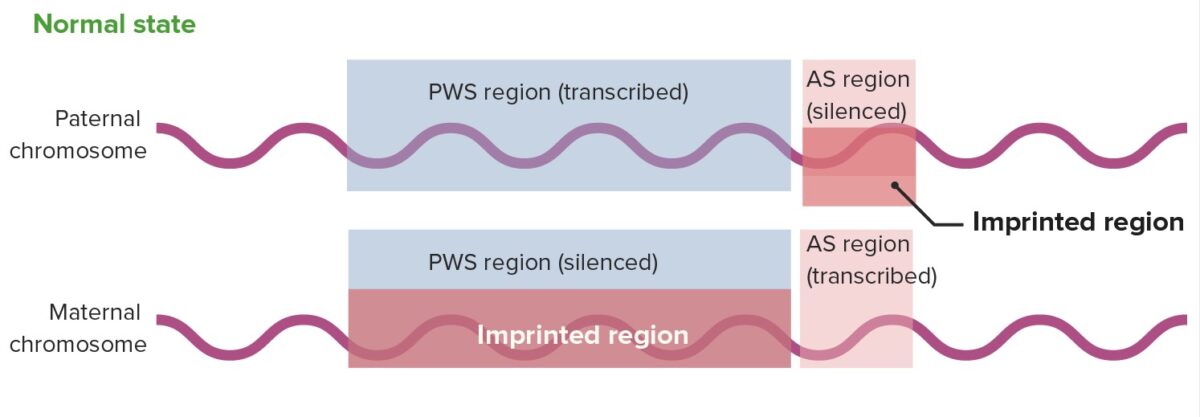
Expresión génica normal en la región 15q11-13
AS: síndrome de Angelman
PWS: síndrome de Prader–Willi
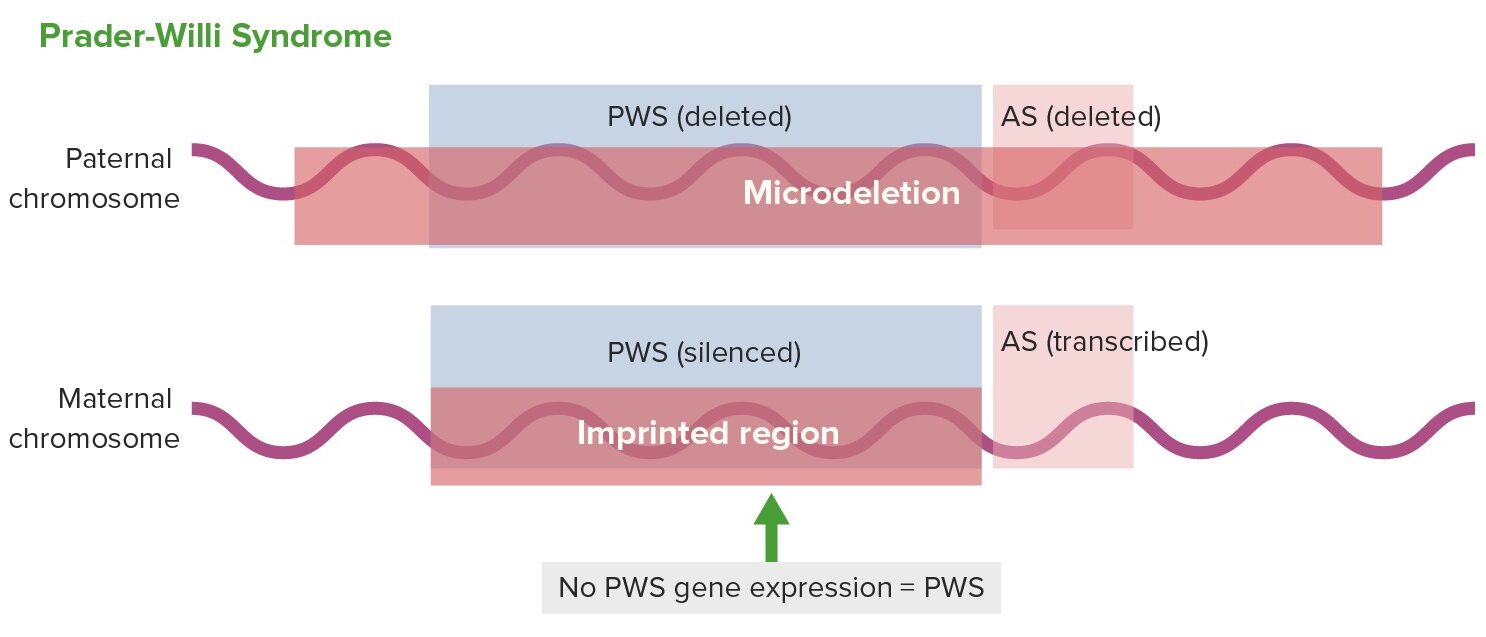
Expresión génica en el síndrome de Prader–Willi:
AS: síndrome de Angelman
PWS: síndrome de Prader–Willi
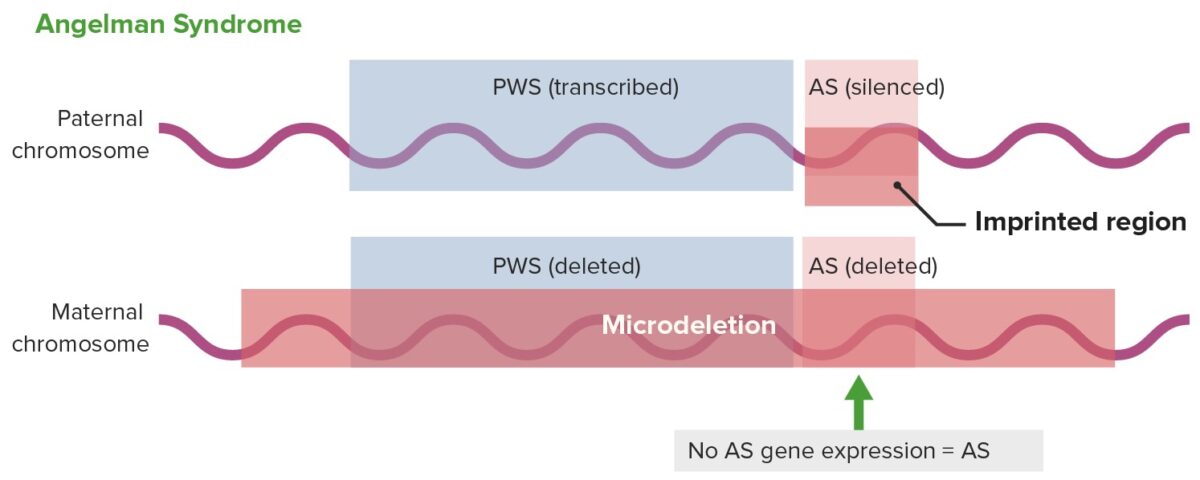
Expresión génica en el síndrome de Angelman
AS: síndrome de Angelman
PWS: síndrome de Prader–Willi