La hipersensibilidad tipo II, también conocida como hipersensibilidad citotóxica mediada por anticuerpos, está causada por anticuerpos de inmunoglobulina G (IgG) e inmunoglobulina M (IgM) dirigidos contra antígenos de células o materiales extracelulares. La reacción da lugar a procesos citotóxicos en los que intervienen los anticuerpos y el sistema del complemento. La interferencia con el funcionamiento normal de las células, generando una disfunción estimulante o inhibitoria, es otro mecanismo que se produce. El antígeno incitante puede ser intrínseco o formar parte de la célula huésped. Los antígenos extrínsecos, como hemoderivados o medicamentos, pueden provocar una reacción similar. Para el diagnóstico, se utilizan pruebas de laboratorio y procedimientos invasivos, dependiendo del sistema afectado. El tratamiento de la enfermedad resultante va desde cuidados de soporte hasta antibióticos, medicamentos inmunosupresores y cirugía.
Última actualización: Dic 20, 2024
Los siguientes mecanismos se desencadenan por la unión de los complejos anticuerpo-antígeno:
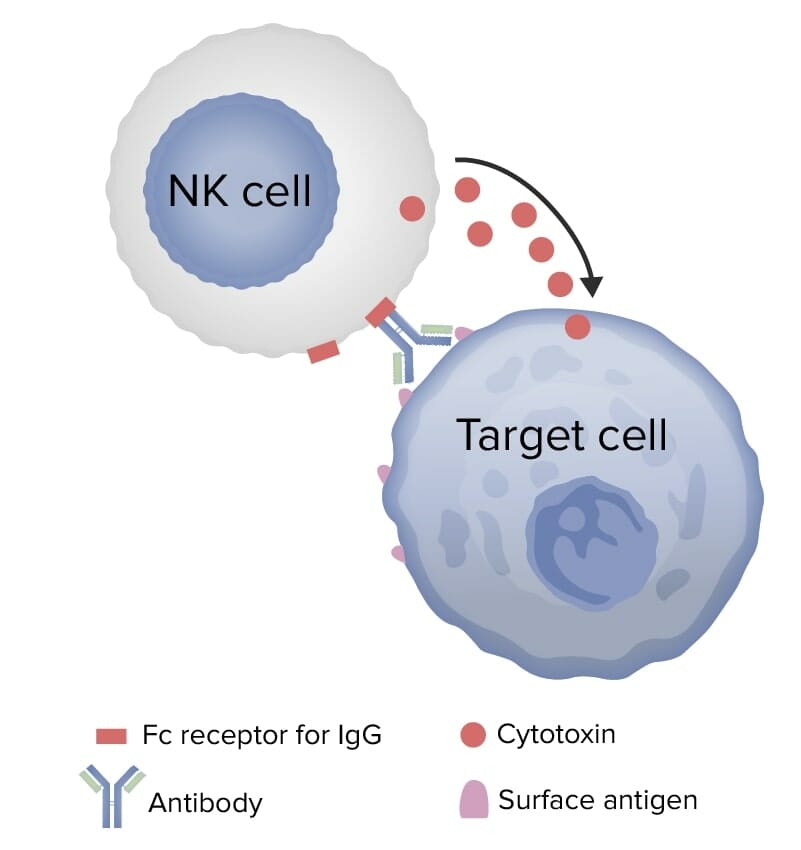
Citotoxicidad celular o mediada por células dependiente de anticuerpos:
El anticuerpo se une a los antígenos de superficie de la célula diana. La célula efectora portadora de Fc (linfocito asesino natural o NK) se une a la región Fc del anticuerpo y libera gránulos citotóxicos que conducen a la lisis de la célula diana.
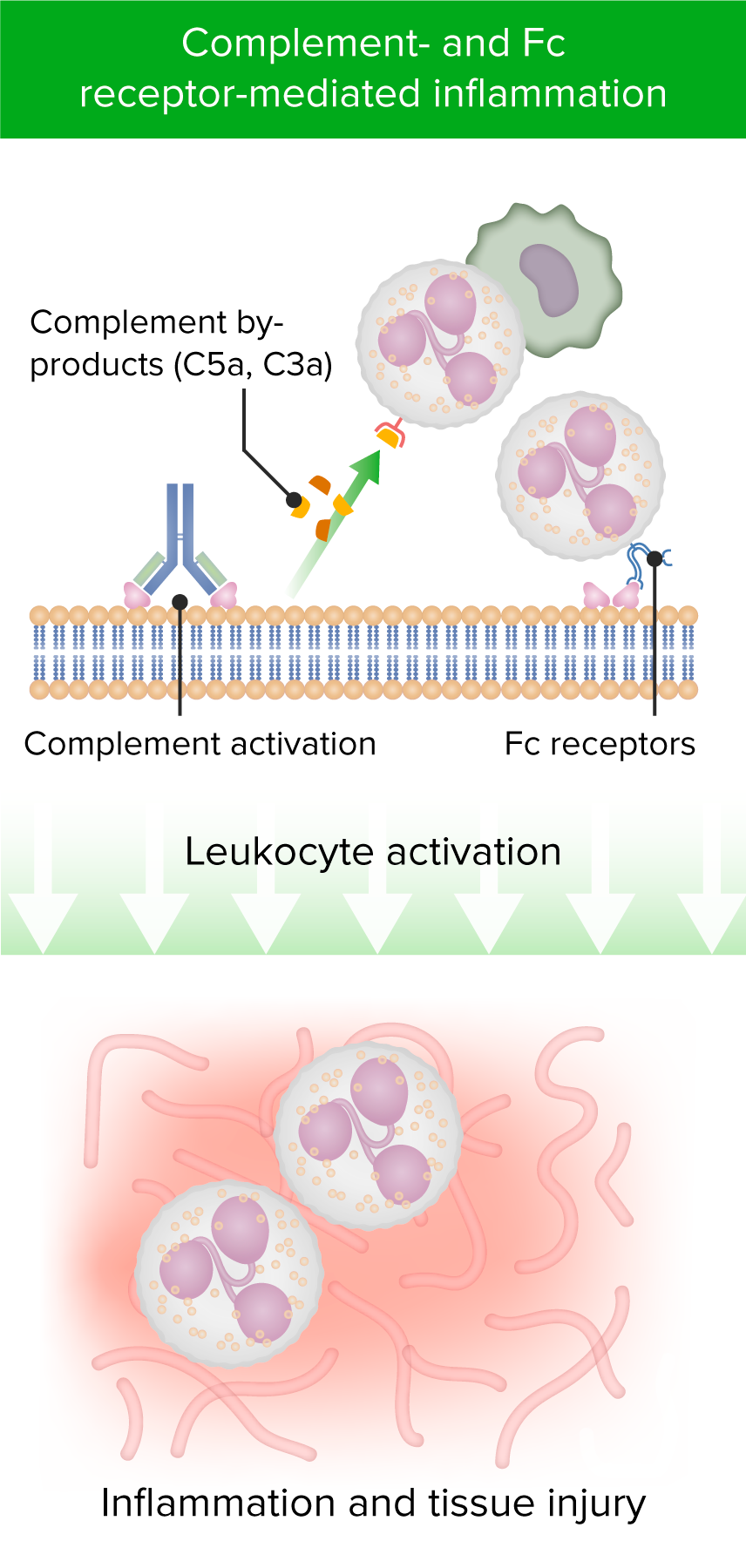
Efectos mediados por los anticuerpos (cuando el anticuerpo se une a las superficies celulares):
Activación del sistema del complemento, de los leucocitos y, en algunos casos, de las células efectoras portadoras de receptores Fc, principalmente las células NK, lo que provoca inflamación y lesiones
La hipersensibilidad tipo II puede ser resultado de las siguientes afecciones:
Reacciones transfusionales (incompatibilidad ABO o de grupo sanguíneo)
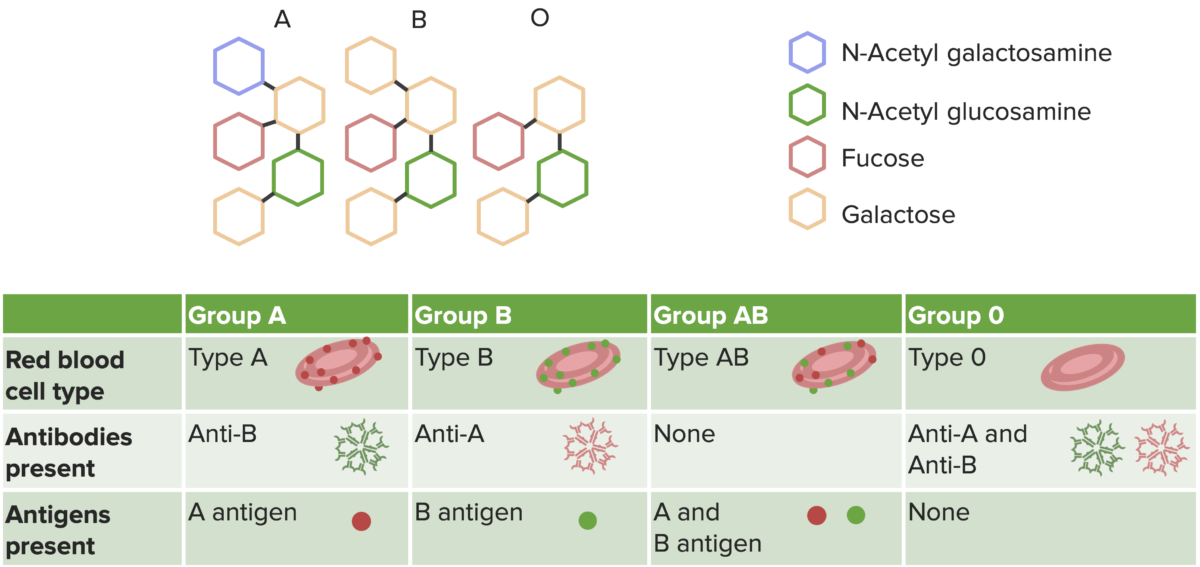
Reacciones transfusionales inducidas por reacciones de hipersensibilidad tipo II. Este diagrama muestra los grupos sanguíneos y sus correspondientes anticuerpos y antígenos.
Imagen por Lecturio.Anemia hemolítica autoinmune (contra los eritrocitos)
Anemia perniciosa (contra el factor intrínseco)
Enfermedad hemolítica del feto y del recién nacido (contra los eritrocitos; incompatibilidad RhD)
Púrpura trombocitopénica autoinmune
Fiebre reumática aguda
Síndrome de Goodpasture
Enfermedad de Graves
Miastenia gravis
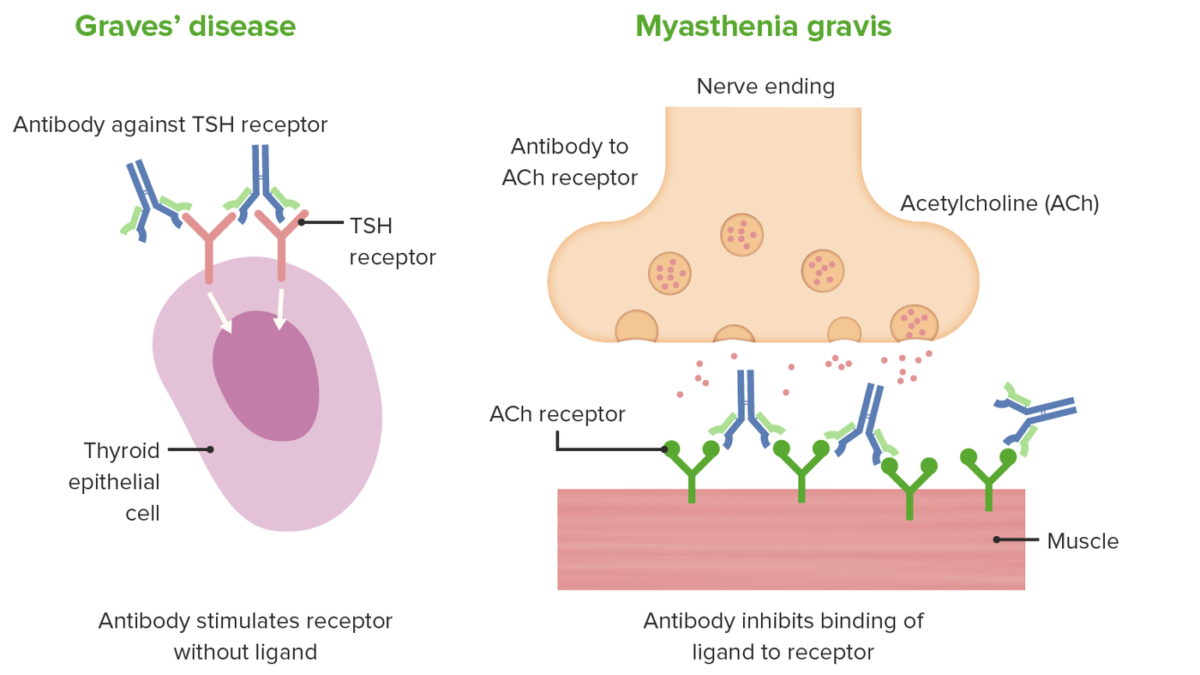
Mecanismo de la enfermedad de Graves (izquierda) y de la miastenia gravis (derecha), ambas causadas por el mecanismo de hipersensibilidad de tipo II.
Imagen por Lecturio.El diagnóstico y el tratamiento varían en función de las manifestaciones, el sistema orgánico implicado y la severidad del deterioro producido por la reacción.
Reacciones transfusionales
Anemia hemolítica autoinmune
Anemia perniciosa
Enfermedad hemolítica del feto y del recién nacido
Púrpura trombocitopénica autoinmune
Fiebre reumática aguda
Síndrome de Goodpasture
Enfermedad de Graves
Miastenia gravis