Los aminoácidos están compuestos por un átomo de carbono central unido a un grupo carboxilo, un grupo amino, un átomo de hidrógeno y una cadena lateral (grupo R). Hay cientos de aminoácidos en la naturaleza, pero solo se utilizan predominantemente 20 como componentes básicos de las proteínas en los seres humanos (proteinogénicos). Nueve de estos 20 son "esenciales", ya que no pueden ser sintetizados. Además de los 20 aminoácidos estándar, también se reconocen 2 aminoácidos proteinógenos poco comunes: la selenocisteína y la pirrolisina. Los aminoácidos solo se diferencian entre sí por la naturaleza química del grupo R. Se suelen clasificar según su interacción con el agua como hidrofóbicos, hidrofílicos o iónicos.
Última actualización: Abr 24, 2025
Cada aminoácido está compuesto por un carbono alfa, o central, unido a:
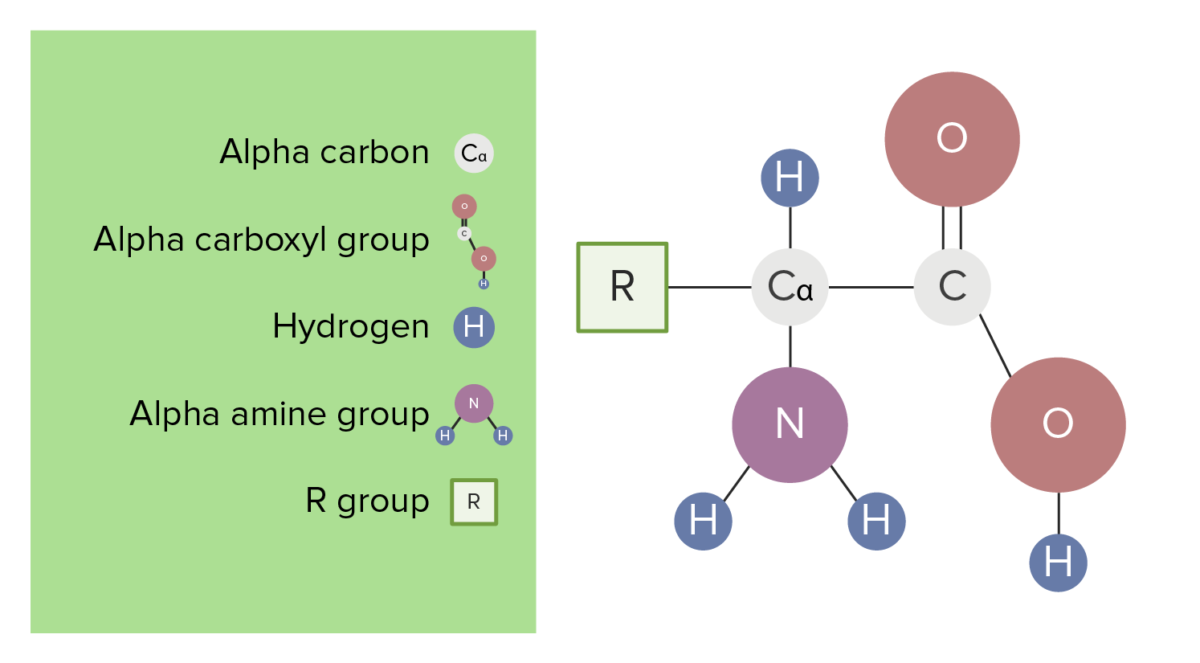
La estructura básica de los aminoácidos
Imagen por Lecturio.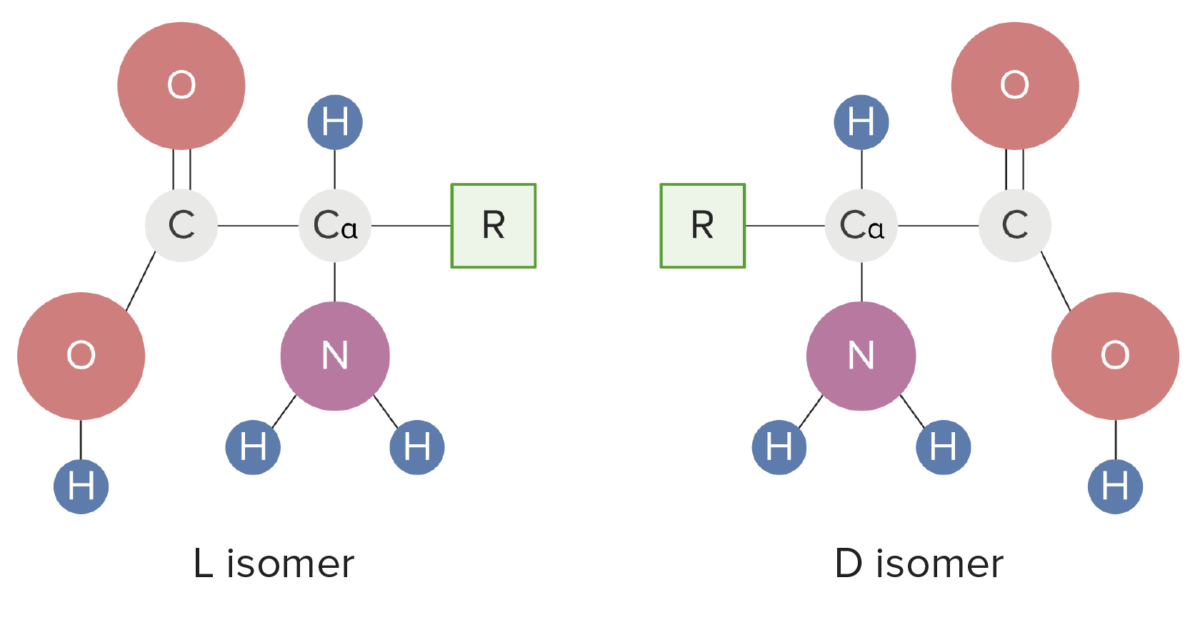
Formas isoméricas de los aminoácidos
Imagen por Lecturio.Los grupos R determinan las diferencias en estructura, función e interacciones biológicas de los aminoácidos .
Los grupos R pueden clasificarse de dos maneras:
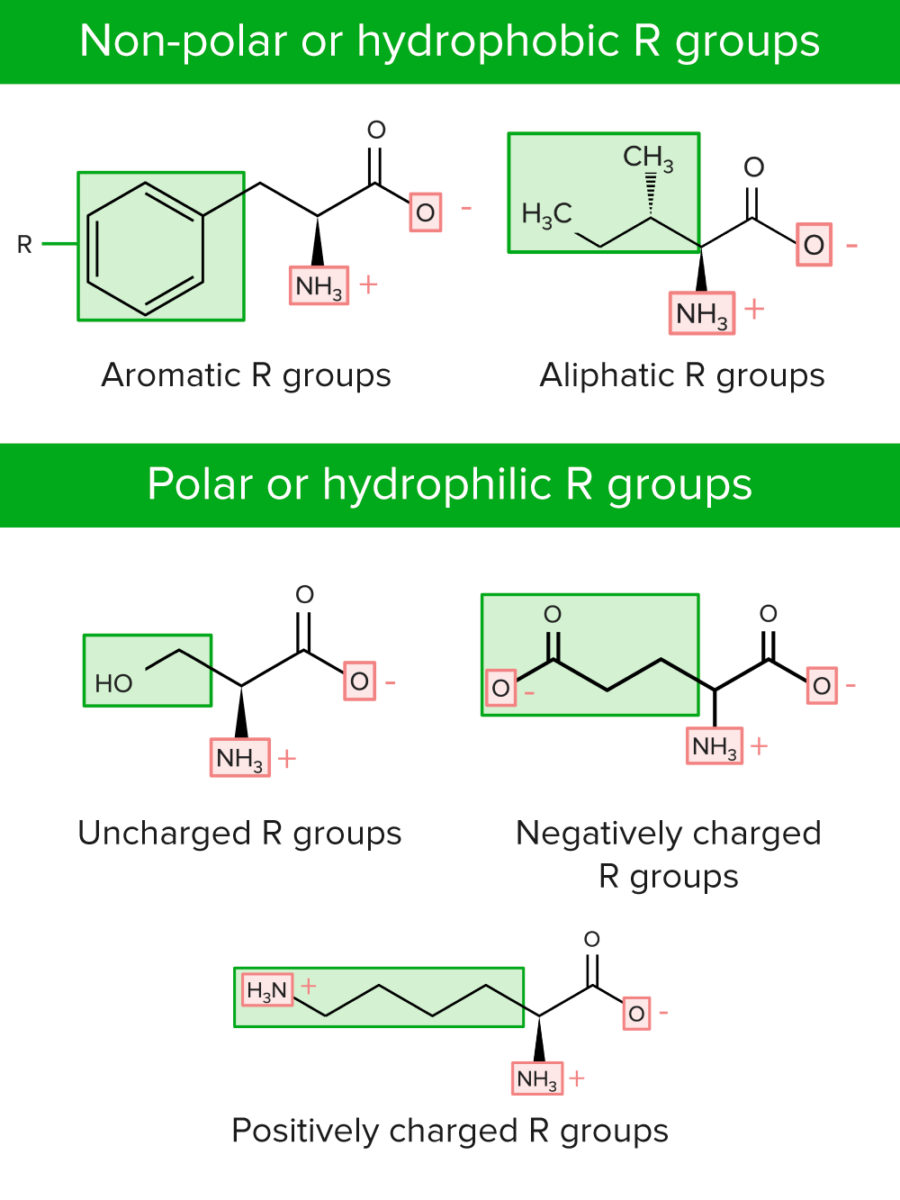
Categorías de grupos R o cadenas laterales de aminoácidos
Imagen por Lecturio.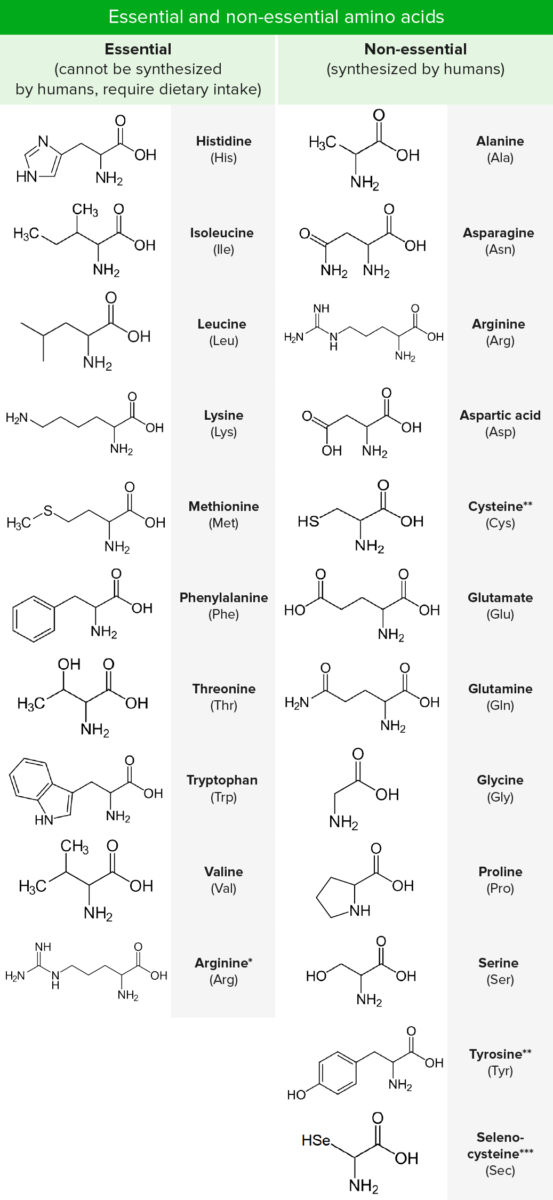
*Solo se requiere durante los períodos de crecimiento o de balance positivo de nitrógeno.
**Sintetizado a partir de aminoácidos esenciales.
***Análogo de la cisteína con selenio en lugar del azufre habitual. No está codificado directamente en el código genético
| No polares o hidrofóbicos | Polar o hidrófilo | ||
|---|---|---|---|
| Aromático |
|
Carga positiva o básica |
|
| Alifático |
|
Sin carga |
|
| Cargado negativamente o ácido |
|
||
Además de los 20 aminoácidos estándar, también se reconocen 2 aminoácidos proteinógenos poco comunes:

Forma de zwitterion
Imagen por Lecturio.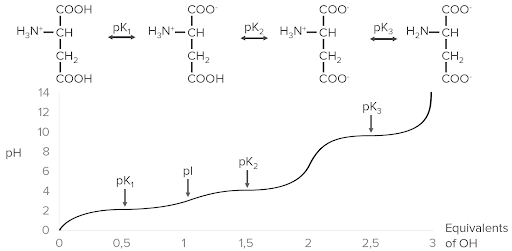
Ejemplo de ionización con ácido aspártico. En la parte superior están las 4 formas diferentes que pueden existir con la ionización. Observe cómo a medida que se añaden equivalentes de hidroxilo (OH), representados en el eje X, el pH (eje Y) aumenta. A medida que aumenta el pH, se alcanzan los puntos pK y se liberan progresivamente más iones de hidrógeno (protones) del ácido aspártico, disminuyendo su carga.
Imagen por Lecturio.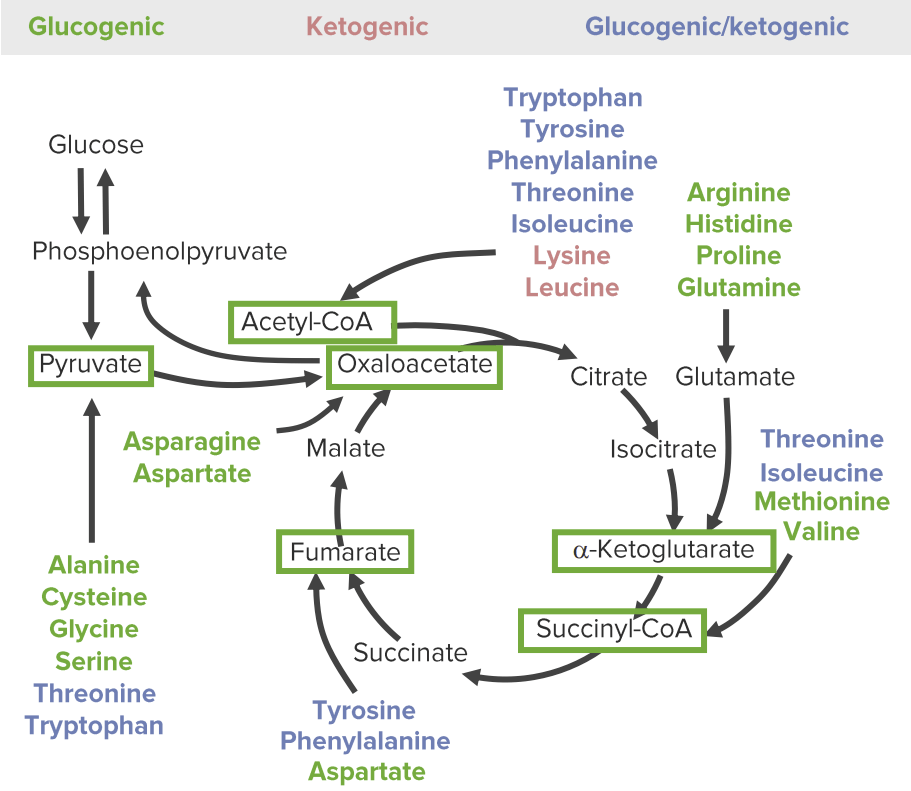
Las 3 categorías de productos catabólicos de los aminoácidos: glucogénicos (verde), cetogénicos (rojo), y ambos glucogénicos y cetogénicos (azul). La vía de la glucosa-piruvato a la izquierda representa la glucólisis y la gluconeogénesis. La vía cíclica de la derecha representa el ciclo del ácido cítrico. Todos los aminoácidos se descomponen en 1 de los 6 intermediarios (recuadros verdes): piruvato, acetil-CoA, oxaloacetato, alfa-cetoglutarato, succinil-CoA y fumarato.
Imagen por Lecturio.El catabolismo de los aminoácidos implica reacciones anapleróticas (reacciones químicas que forman intermediarios de las vías metabólicas).
Los aminoácidos pueden clasificarse por los productos catabólicos y en qué vías metabólicas servirán como intermediarios: