La farmacocinética es la ciencia que analiza cómo el cuerpo humano interactúa con un medicamento. La farmacocinética examina cómo el cuerpo absorbe, distribuye, metaboliza y excreta el medicamento. La farmacodinamia es la ciencia que estudia los efectos bioquímicos y fisiológicos de un medicamento y su mecanismo de acción específico de un órgano, incluidos los efectos a nivel celular. Otra forma de describir la diferencia entre las 2 disciplinas es decir que la farmacocinética es "lo que el cuerpo le hace al medicamento", mientras que la farmacodinamia es "lo que el medicamento le hace al cuerpo". Al prescribir medicamentos, los médicos deben tener en cuenta tanto la farmacodinamia como la farmacocinética del medicamento para determinar la dosis correcta y garantizar el efecto adecuado.
Última actualización: Mar 27, 2025
La farmacocinética y la farmacodinamia son campos de estudio que se centran en la interacción entre los medicamentos y el cuerpo.
La farmacocinética es el estudio de cómo el cuerpo humano interactúa con un medicamento:
La farmacodinamia es el estudio de los efectos de un medicamento y su mecanismo de acción específico en cada órgano, incluidos los efectos a nivel celular:
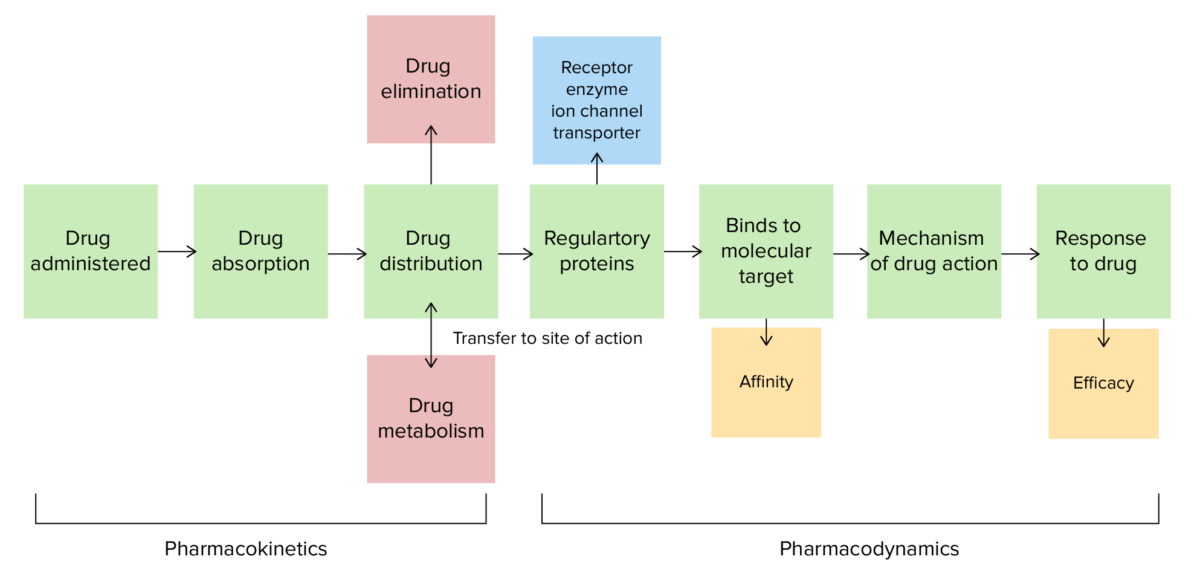
Farmacocinética y farmacodinamia
Imagen por Lecturio.La absorción es la transferencia de un medicamento o sustancia desde el sitio de administración al torrente sanguíneo y está determinada por:
La absorción a través del tracto gastrointestinal se ve afectada por:
Los medicamento atravesarán las membranas a través de:
D: constante de difusión del medicamento
A: área de superficie de la membrana
T: espesor de la membrana
C: gradiente de concentración
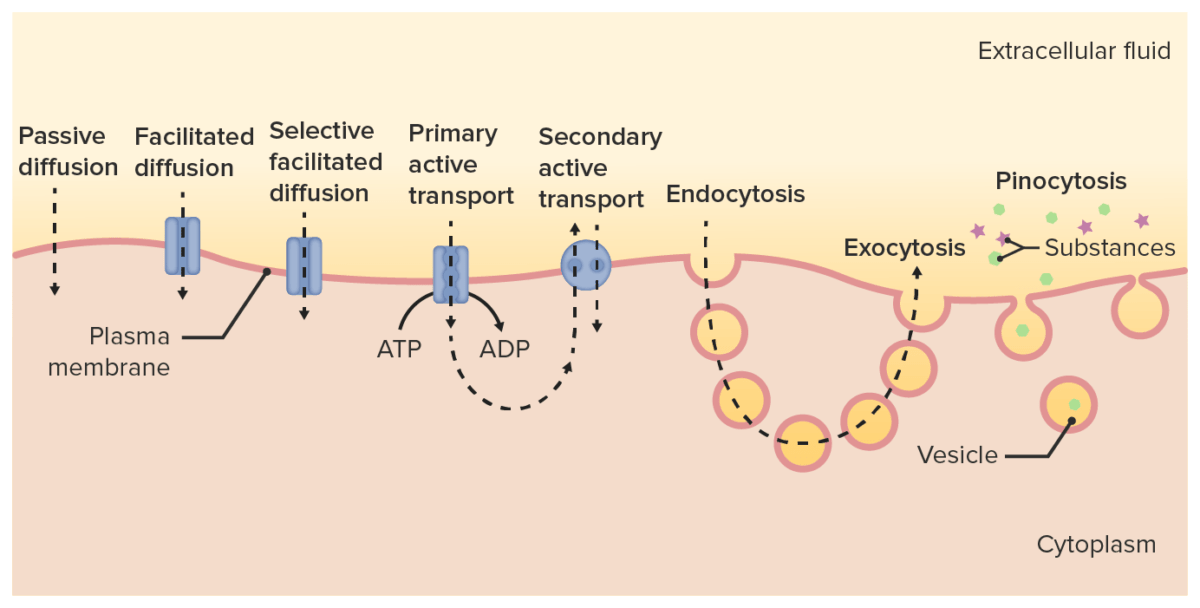
Diferentes vías de transporte de fármacos a través de la membrana celular y hacia el citoplasma
Imagen por Lecturio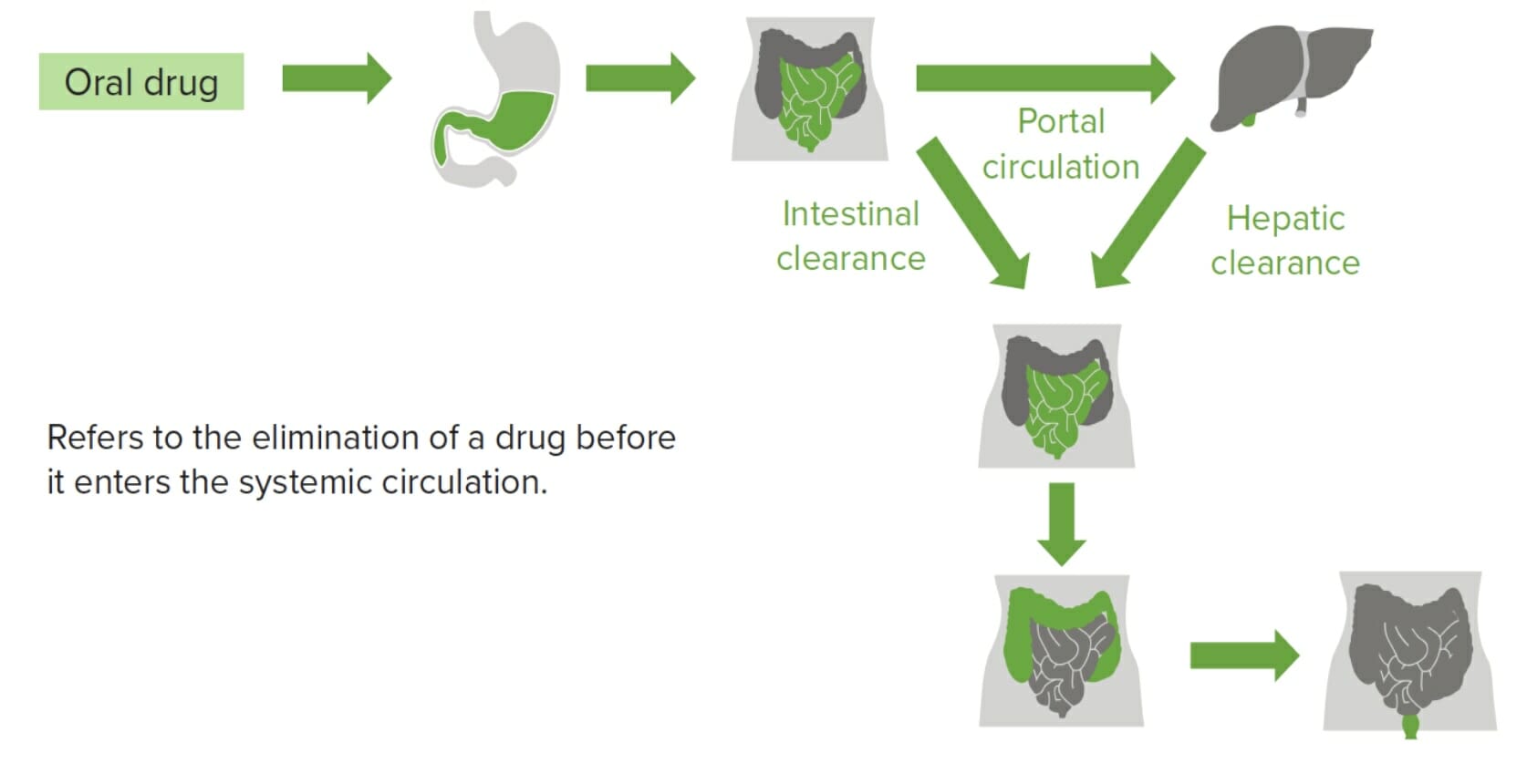
Fenómeno en el que un fármaco se somete al metabolismo de primer paso en el que se metaboliza parcial o totalmente en la pared intestinal, o se absorbe en el intestino y entra en la circulación portal y viaja al hígado donde el fármaco se metaboliza aún más.
Imagen por Lecturio.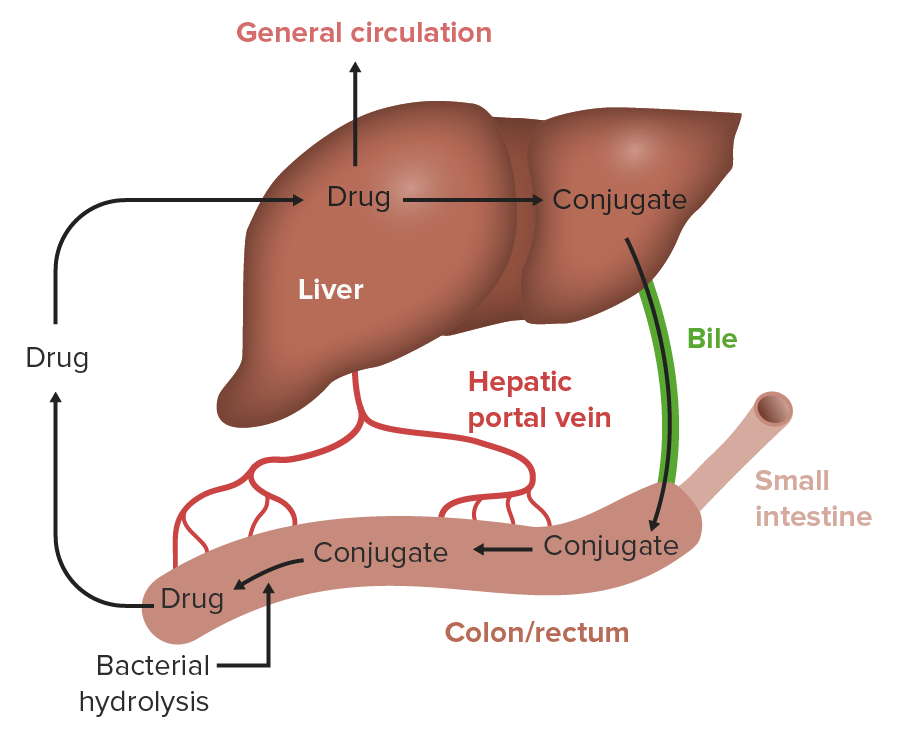
Circulación enterohepática
Imagen por LecturioLa distribución es la medida en que un medicamento se transporta desde la circulación sistémica a los tejidos y órganos diana.
La ecuación para el volumen de distribución:
$$ V_{d}= \frac{Cantidad\ del\ medicamento\ en\ el\ cuerpo}{Concentración\ en\ la\ sangre} $$La biotransformación es el proceso a través del cual el cuerpo humano transforma químicamente los medicamentos en diferentes moléculas para hacer que el compuesto sea farmacológicamente activo o para facilitar la eliminación.
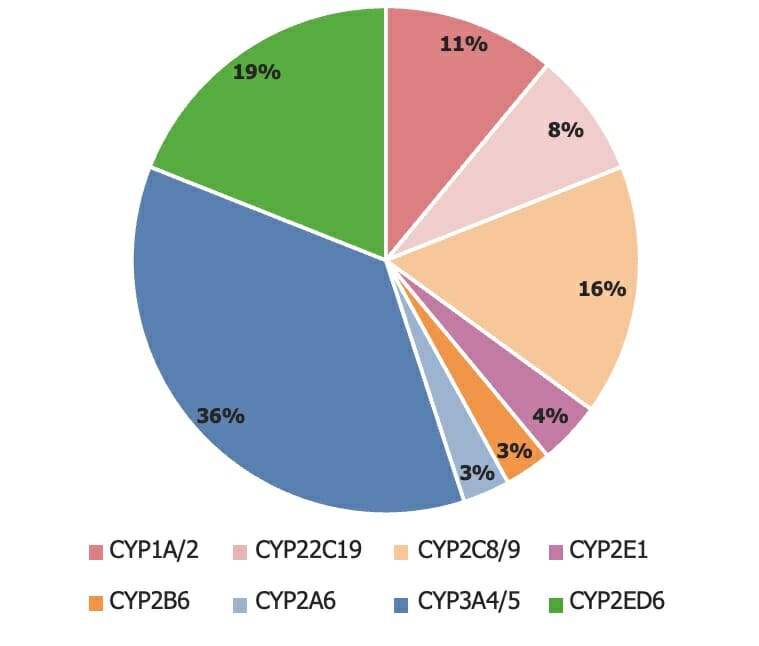
La variedad de isoenzimas del citocromo P450 (CYP450)
Imagen por Lecturio.Los receptores son macromoléculas involucradas en la señalización química entre y dentro de las células.
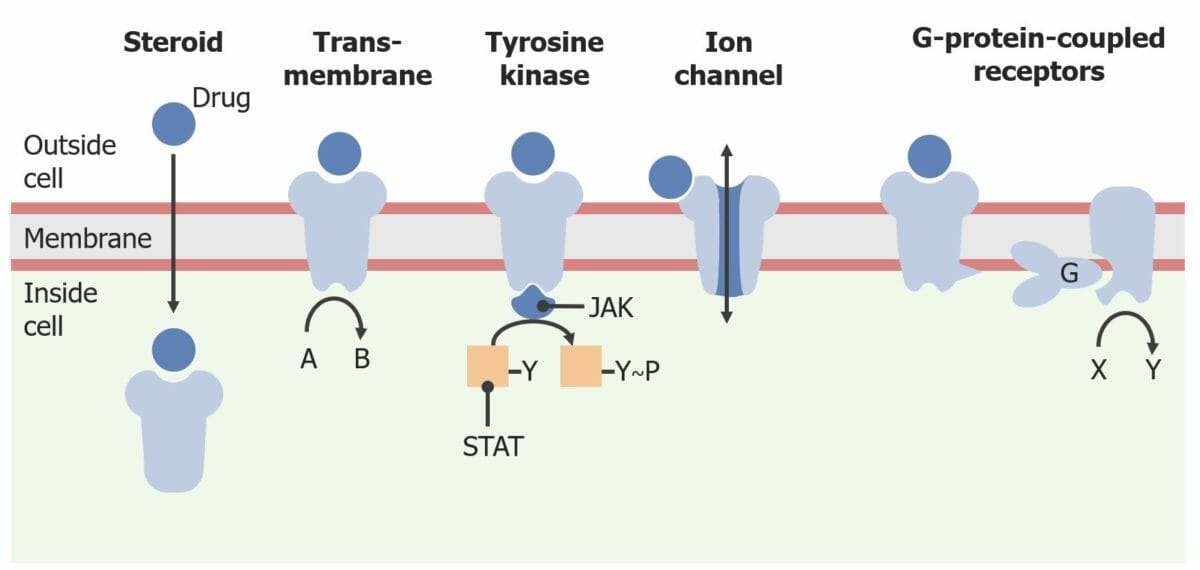
Diferentes categorías de receptores intracelulares y de superficie celular
Imagen por Lecturio.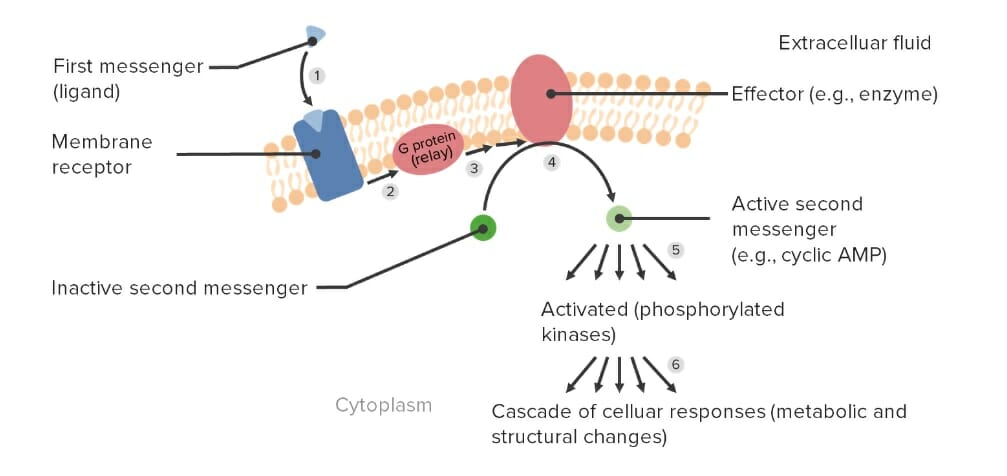
Transducción de señales mediada por proteína G y activación de un sistema de 2do mensajero:
(1) El 1er mensajero o medicamento se une al receptor acoplado a proteína G y (2) activa la proteína G, que (3) transmite una señal para (4) activar la molécula efectora.
Luego, el efector (5) activa 2dos mensajeros para (6) provocar respuestas celulares.
El efecto de un medicamento es la respuesta física que provoca. Este puede ser un efecto deseado (terapéutico) o un efecto no deseado (tóxico). El efecto puede ser modulado por la presencia de antagonistas y también está determinado por su afinidad con su receptor molecular diana. Estos efectos son medidos y se pueden representar visualmente a través de curvas.
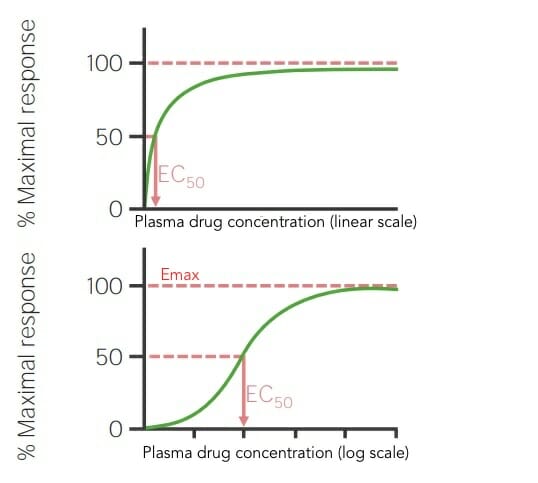
Curvas de dosis-respuesta en escala lineal y logarítmica que muestran la dosis o concentración del medicamento que provoca un efecto máximo (Emax) y la concentración del medicamento que produce el 50% efecto máximo (EC50)
Imagen por Lecturio.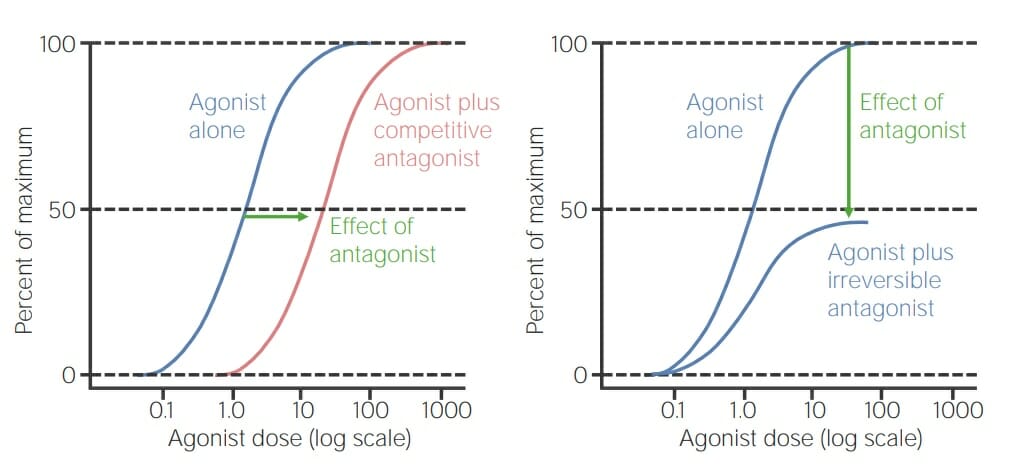
Curva de dosis-respuesta que compara el agonista solo versus el agonista con un antagonista competitivo (izquierda):
Obsérvese que el mismo efecto ocurre con una dosis más alta de agonista cuando se disocia el antagonista competitivo. La curva simplemente se desplaza hacia la derecha.
Curva derecha: en comparación, esta es una curva de dosis-respuesta que compara el agonista solo versus el agonista con un antagonista irreversible. Las 2 curvas parten de la misma concentración, pero alcanzan puntos máximos diferentes dado que la acción antagonista irreversible es independiente de la concentración del agonista. La respuesta se reduce al 50% de su potencial máximo.
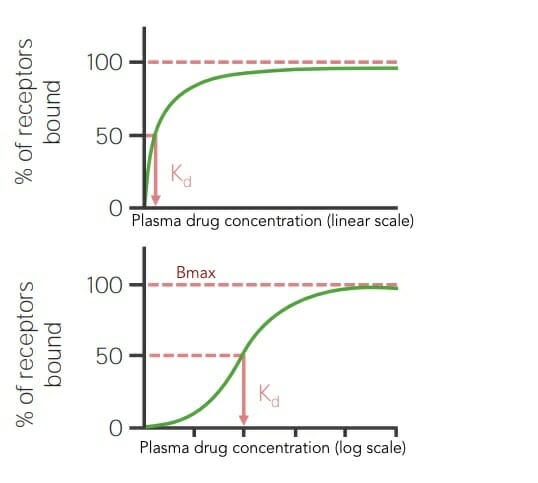
Curvas de unión en escala lineal y logarítmica que muestran la respuesta biológica máxima (Bmax) y la constante de disociación (Kd) para un medicamento
Imagen por Lecturio.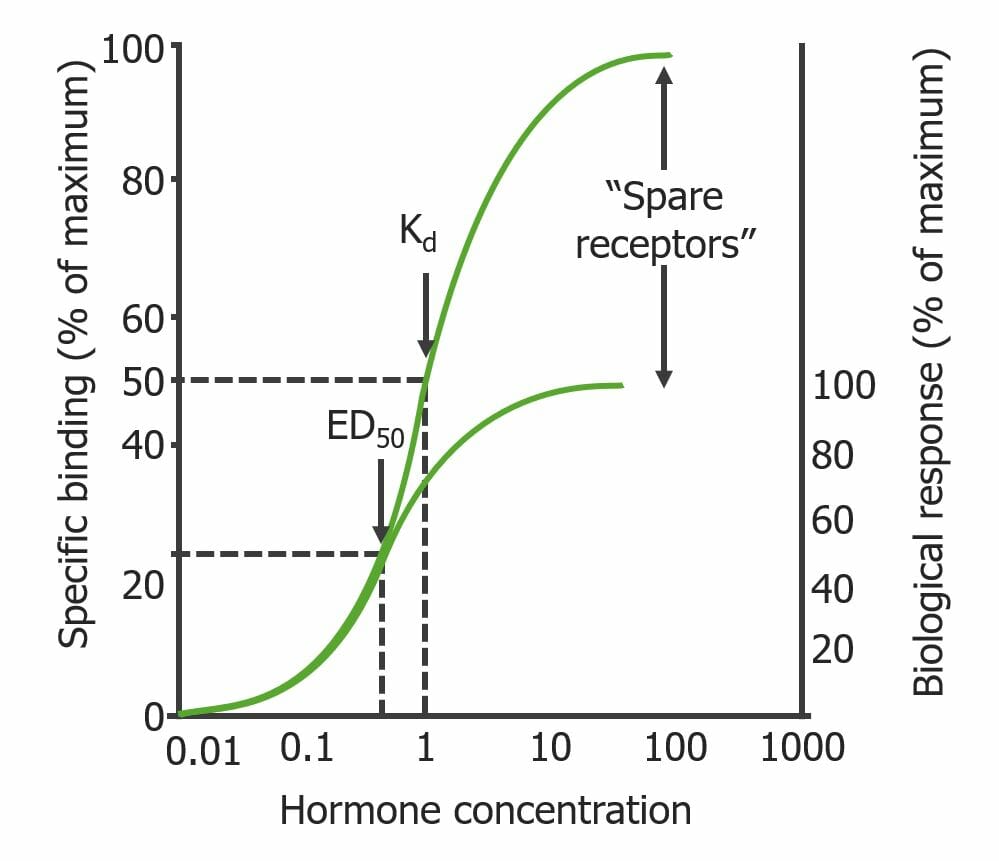
Curva de unión que ilustra el fenómeno del «receptor de repuesto»:
Hay una respuesta biológica máxima a pesar de la presencia de receptores que no están unidos al medicamento. Obsérvese que la concentración de medicamento requerida para ocupar el 50% de los receptores (Kd) es mayor que la concentración necesaria para provocar una respuesta máxima (ED50): Kd > ED50.
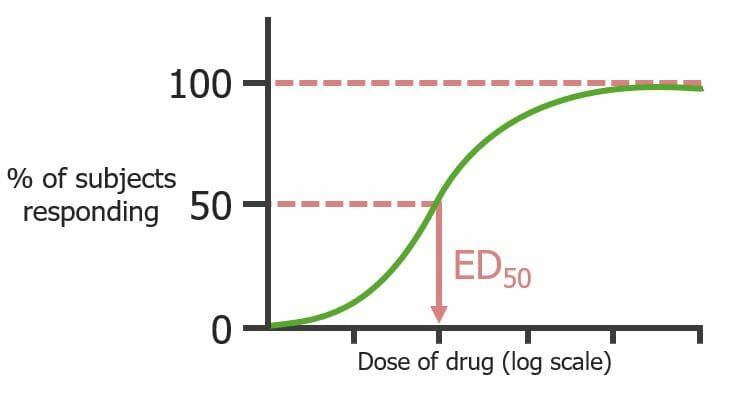
Curva dosis-respuesta cuantal (observa la población, no los receptores individuales) que señala la dosis de un medicamento que produce un efecto predeterminado en el 50% de los sujetos (E50)
Imagen por Lecturio.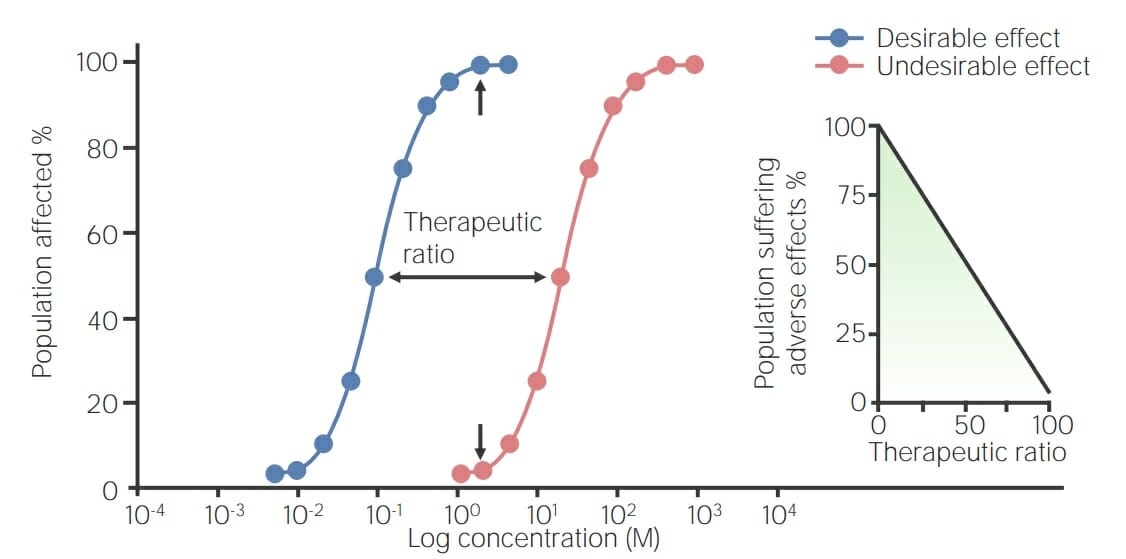
Gráfico de una curva de toxicidad:
La curva azul de dosis-respuesta representa el efecto deseado de un medicamento en una población, y la curva roja de dosis-toxicidad representa el efecto indeseable del medicamento. La relación terapéutica, o índice terapéutico, se encuentra entre las 2 curvas y es igual a la dosis para un efecto tóxico en el 50% de la población/concentración del medicamento que produce el 50% del efecto máximo (TD50/EC50), comenzando en el 50% de la dosis máxima efectiva y finalizando en el 50% de la dosis tóxica. El recuadro muestra la relación entre la proporción terapéutica y los efectos secundarios observados. A mayor proporción terapéutica, menor aparición de efectos secundarios y viceversa.
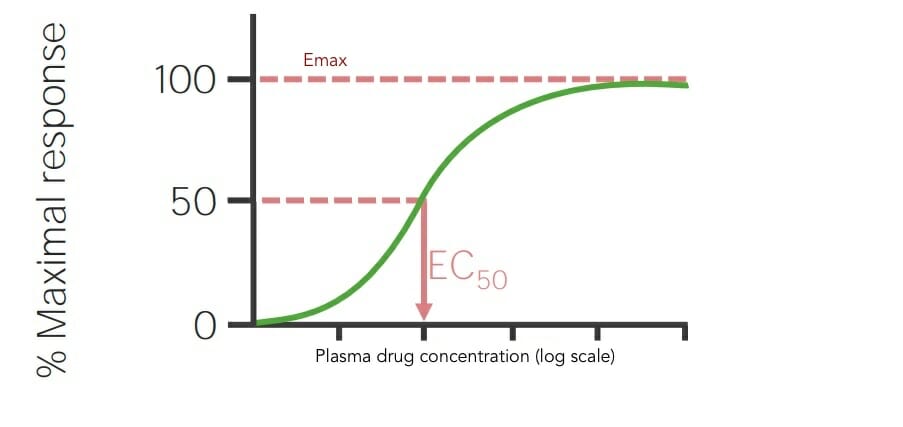
Ilustración de las curvas de dosis-respuesta de diferentes medicamentos para comparar su concentración necesaria para producir un efecto máximo del 50% (EC50):
Emax es el efecto máximo. Menor EC50 = mayor potencia. El medicamento que se encuentra más a la izquierda en el gráfico (representado por la línea gris punteada) tiene la potencia más alta de los 4 medicamentos representados porque tiene la concentración más baja (indicada en el eje x) necesaria para producir un efecto máximo del 50%. Cambiando de las curvas de izquierda a derecha, la potencia de los medicamentos disminuye, siendo la línea gris sólida en el extremo derecho el medicamento menos potente.
La eliminación es el proceso de conversión de un medicamento en metabolitos inactivos, que finalmente se excretan del cuerpo.
Velocidad de eliminación del medicamento (masa/tiempo) = aclaramiento x concentración.
General:
Cálculo del aclaramiento renal:
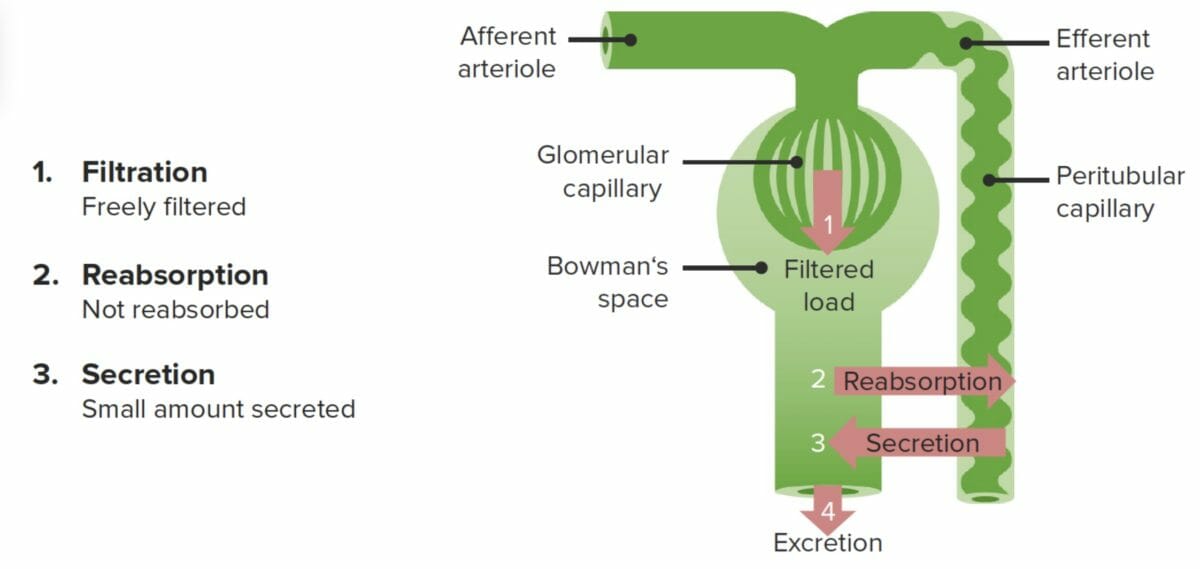
La creatinina es el principal marcador de filtración renal utilizado clínicamente para estimar la tasa de filtración glomerular (TFG):
La creatinina se filtra libremente y no se reabsorbe. Sin embargo, la creatinina también es secretada por los capilares peritubulares, lo que provoca una sobrestimación de alrededor del 10% de la TFG.
| Horas | Cantidad de medicamento (mg/L) que queda en el cuerpo | % de medicamento eliminado | Cantidad de medicamento (mg/L) eliminado |
|---|---|---|---|
| 0 | 1 | — | — |
| 1 | 0,85 | 15 | 0,15 |
| 2 | 0,70 | 18 | 0,15 |
| 3 | 0,55 | 21 | 0,15 |
| 4 | 0,40 | 27 | 0,15 |
| 5 | 0,25 | 38 | 0,15 |
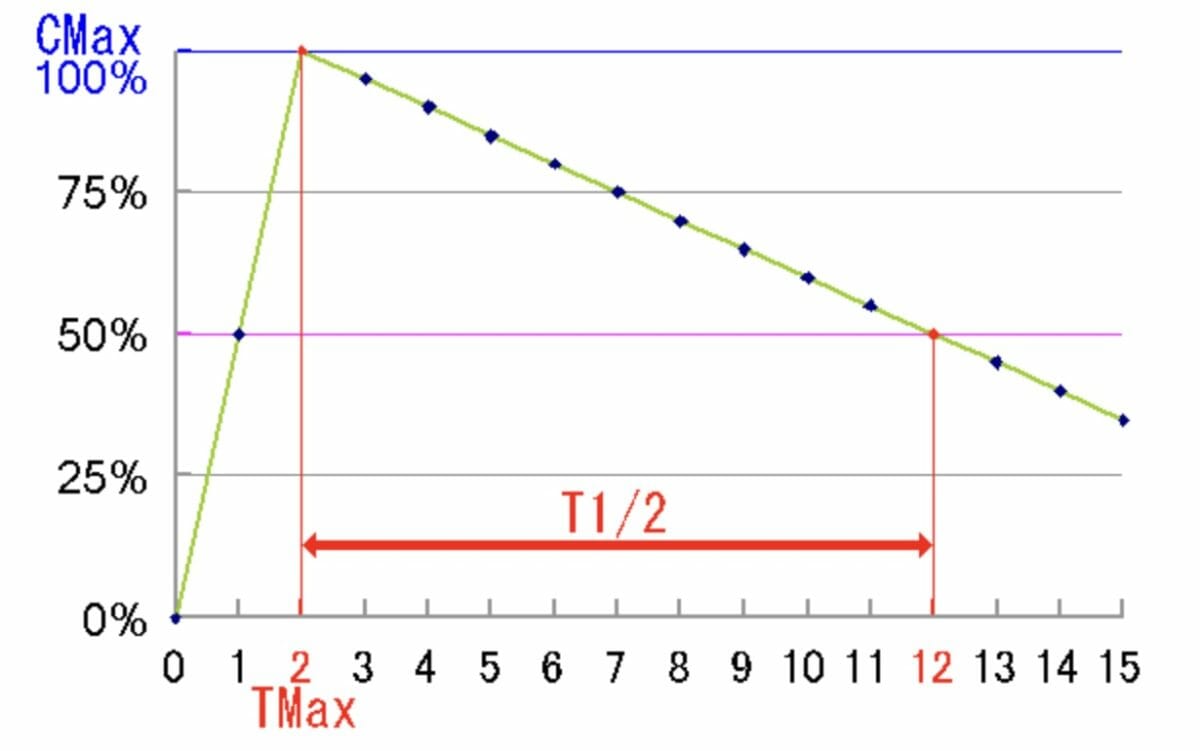
Representación gráfica de la vida media de un medicamento:
En este ejemplo, la vida media es de 10 horas. Cmax = concentración máxima de medicamento en el torrente sanguíneo, Tmax = tiempo en el que la concentración de medicamento en la sangre está en su máximo. T 1/2 = vida media, el tiempo que tarda el nivel del medicamento en pasar de Cmax a la mitad de Cmax.

Representación gráfica del medicamento en la tabla anterior que experimenta una cinética de eliminación de orden cero:
El eje X es la unidad de tiempo en horas, y el eje Y es la cantidad de medicamento, en miligramos, que queda en el cuerpo (o concentración plasmática del medicamento). En el momento cero, hay 1,0 mg de medicamento presente y se elimina una cantidad igual de medicamento cada hora; en este ejemplo, 0,15 mg.
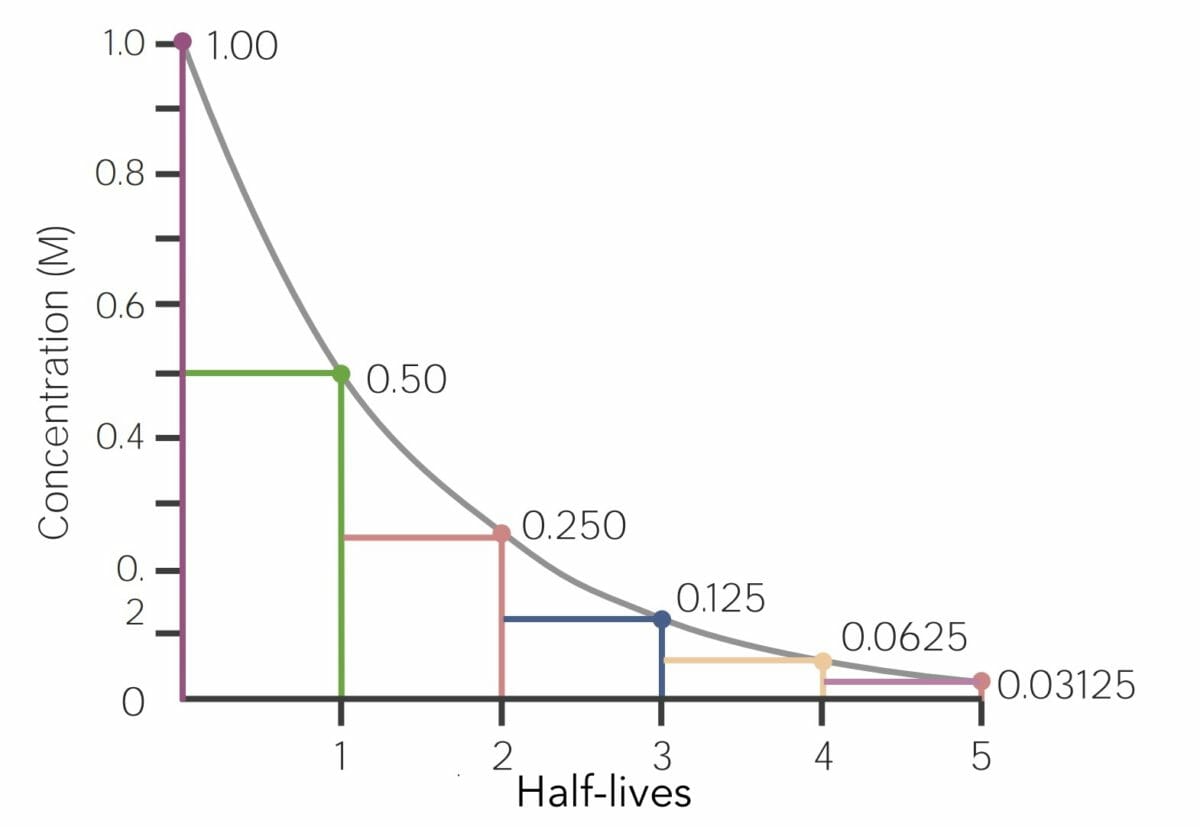
Ejemplo de representación gráfica de un medicamento que experimenta una cinética de eliminación de 1er orden:
El eje X es la unidad de tiempo en horas, y el eje Y es la cantidad de medicamento, en miligramos, que queda en el cuerpo (o concentración plasmática del medicamento). En el tiempo cero, hay 1,0 mg de medicamento presente y luego se elimina un porcentaje/proporción igual del medicamento (en este ejemplo, 50 %) cada hora.