Las anemias sideroblásticas son un grupo heterogéneo de trastornos de la médula ósea caracterizados por la acumulación anormal de hierro en las mitocondrias de los precursores eritroides. El hierro acumulado aparece como gránulos en una distribución anular alrededor del núcleo, dando lugar al rasgo morfológico característico de un sideroblasto anular. Las anemias sideroblásticas pueden deberse a defectos hereditarios en la síntesis del hemo o pueden adquirirse a través del alcoholismo, intoxicación por plomo, medicamentos o deficiencias vitamínicas. La anemia suele ser microcítica con un recuento reticulocitario de bajo a normal. Los niveles de hierro en suero suelen estar elevados. Un examen de la médula ósea que muestra sideroblastos en anillo establece el diagnóstico. El tratamiento implica el abordaje de la enfermedad subyacente, evitar los medicamentos y/o las toxinas causantes y la flebotomía en los casos de sobrecarga de hierro.
Última actualización: Abr 26, 2025
Las anemias sideroblásticas son un grupo heterogéneo de trastornos de la médula ósea caracterizados por la acumulación anormal de hierro en las mitocondrias de los precursores eritroides.
La distribución del hierro es en forma de anillo alrededor del núcleo, manifestado por los precursores (sideroblastos en anillo) en la médula ósea.
Trastornos congénitos:
Adquirida:
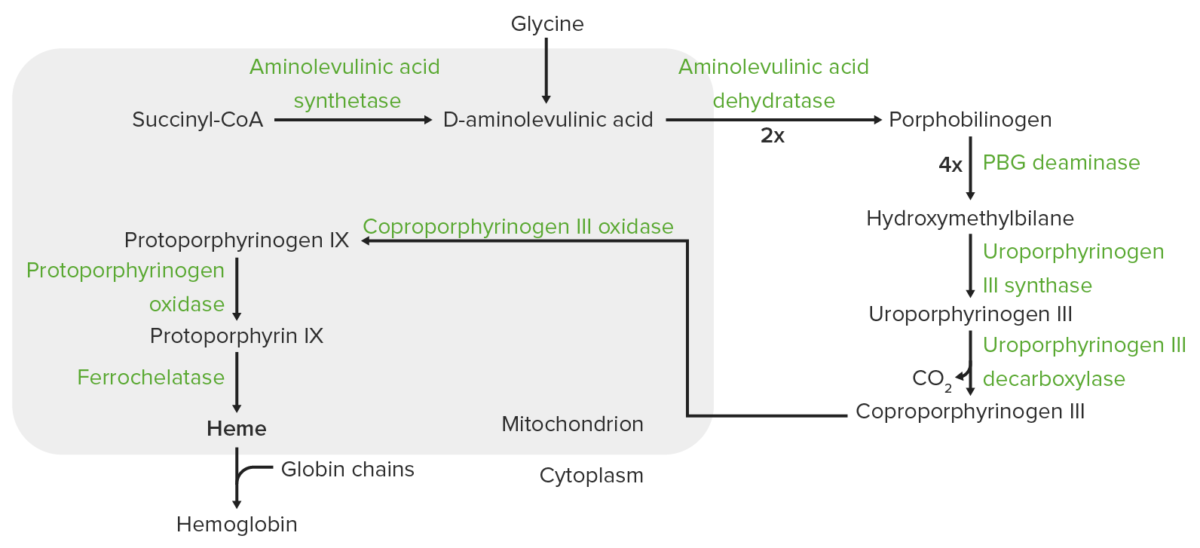
Síntesis del hemo:
La síntesis del hemo es un proceso que tiene lugar en la mitocondria y el citoplasma.
En la mitocondria, el succinil-CoA se combina con la glicina para formar el ácido aminolevulínico (ALA).
Esta reacción es catalizada por la sintasa del ácido aminolevulínico (ALAS2 en los eritrocitos). El ALA sale al citoplasma, donde 2 moléculas de ALA se condensan para producir porfobilinógeno. Los pasos siguientes conducen a la formación de coproporfirinógeno III, que es transportado de vuelta a la mitocondria. La oxidasa facilita la conversión del coproporfirinógeno III en protoporfirinógeno IX, que luego se convierte en protoporfirina IX. El hierro ferroso se inserta en la protoporfirina IX, formando hemo (catalizado por la ferroquelatasa).
Defectos en la síntesis del hemo:
Defectos en la biogénesis de los grupos hierro-azufre:
Defectos en la síntesis de proteínas mitocondriales:
Disfunción de la eritropoyesis:
La presentación clínica varía en función de la enfermedad subyacente.
Características generales de la anemia:
Los pacientes con déficit de vitamina B6 pueden tener:
Los pacientes con intoxicación por plomo pueden tener:
Otros:
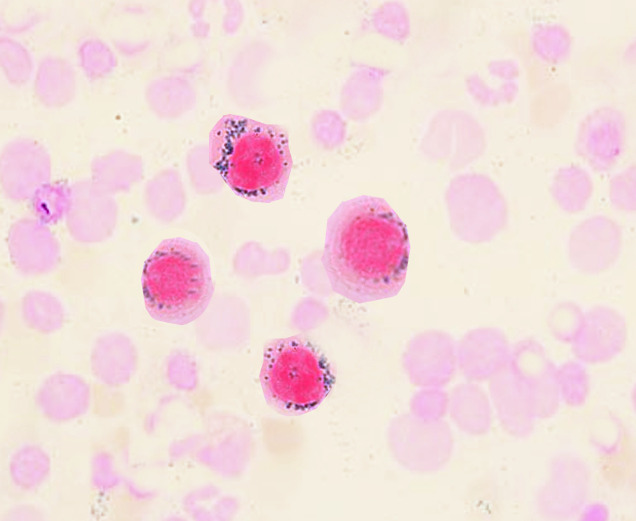
Sideroblastos en anillo
Imagen: “Ringed sideroblasts” por S. Bhimji, MD. Licencia: CC BY 4.0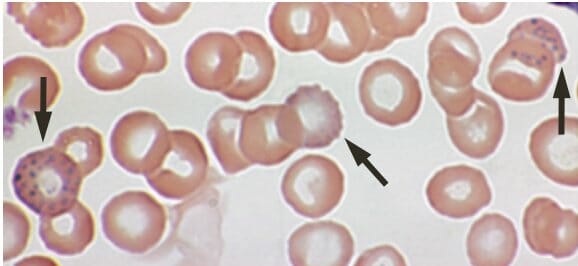
Intoxicación por plomo:
Punteado basófilo en un frotis de sangre periférica de una persona de 53 años con anemia que se queja de fatiga y estreñimiento
| Hallazgo del hemograma | Diagnóstico | Nivel de hierro | Características o antecedentes |
|---|---|---|---|
| Anemia con VCM < 80 | Anemia sideroblástica | ↑ Nivel de hierro | Alcoholismo, síndrome mielodisplásico |
| Anemia ferropénica | ↓ Nivel de hierro | Pérdida de sangre | |
| Talasemia | Nivel normal de hierro | Variante dependiente (anemia de asintomática a grave) |
Las opciones de tratamiento dependen de la etiología e incluyen: