La traducción es el proceso de síntesis de una proteína a partir de un transcrito de ácido ribonucleico (ARN) mensajero (ARNm). Este proceso se divide en tres etapas principales: iniciación, elongación y terminación. La traducción es catalizada por estructuras conocidas como ribosomas, que son grandes complejos de proteínas y ARN ribosómico (ARNr). El ribosoma “lee” el ARNm y aporta los ARN de transferencia (ARNt), cada uno de ellos unido a un aminoácido específico, en el orden correcto. A continuación, estos aminoácidos se unen entre sí mediante un componente enzimático del ribosoma conocido como peptidil transferasa. La traducción puede ser regulada en múltiples pasos, incluso a través de un proceso conocido como interferencia de ARN. En este proceso intervienen pequeños segmentos de ARN de doble cadena que son capaces de inhibir la traducción de los ARNm.
Última actualización: May 19, 2025
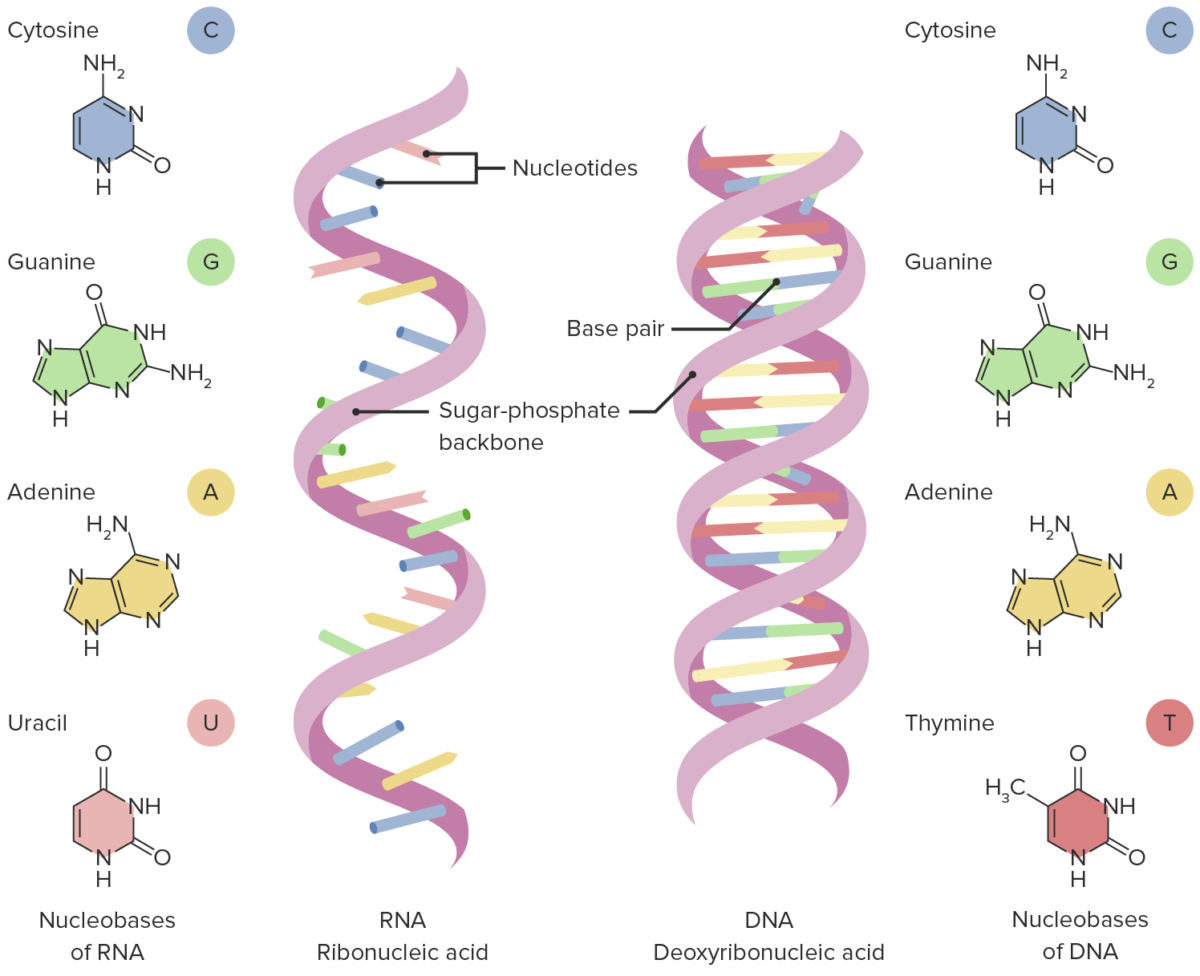
Estructuras de ARN y ADN
Imagen por Lecturio.El código genético es la forma en que los organismos traducen una secuencia de bases en una proteína real.
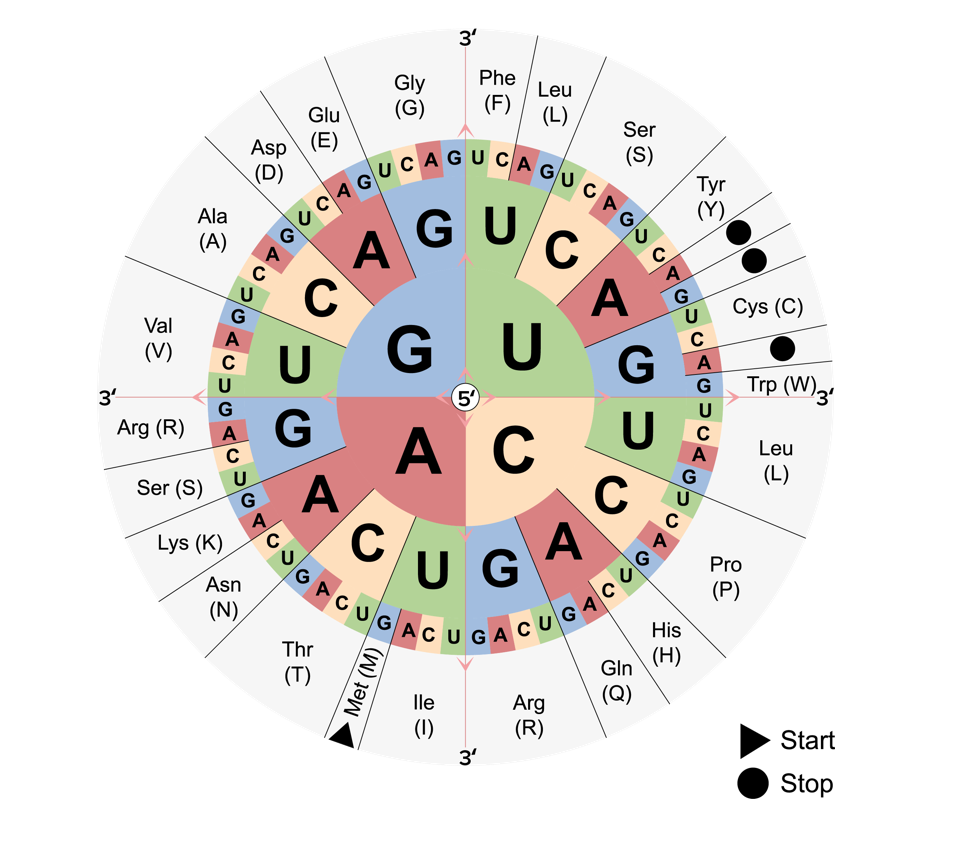
El código genético: empieza en el centro y se lee hacia afuera para determinar qué aminoácidos codifica cada uno de los 64 codones. Se observan los codones de inicio y parada.
Imagen por Lecturio.Los ARNm son traducidos a proteínas por los ribosomas y los ARN de transferencia.
Los ARNt transportan los aminoácidos a los ribosomas, donde se unen al ARNm, alineando los aminoácidos que se unirán para formar el polipéptido en crecimiento.
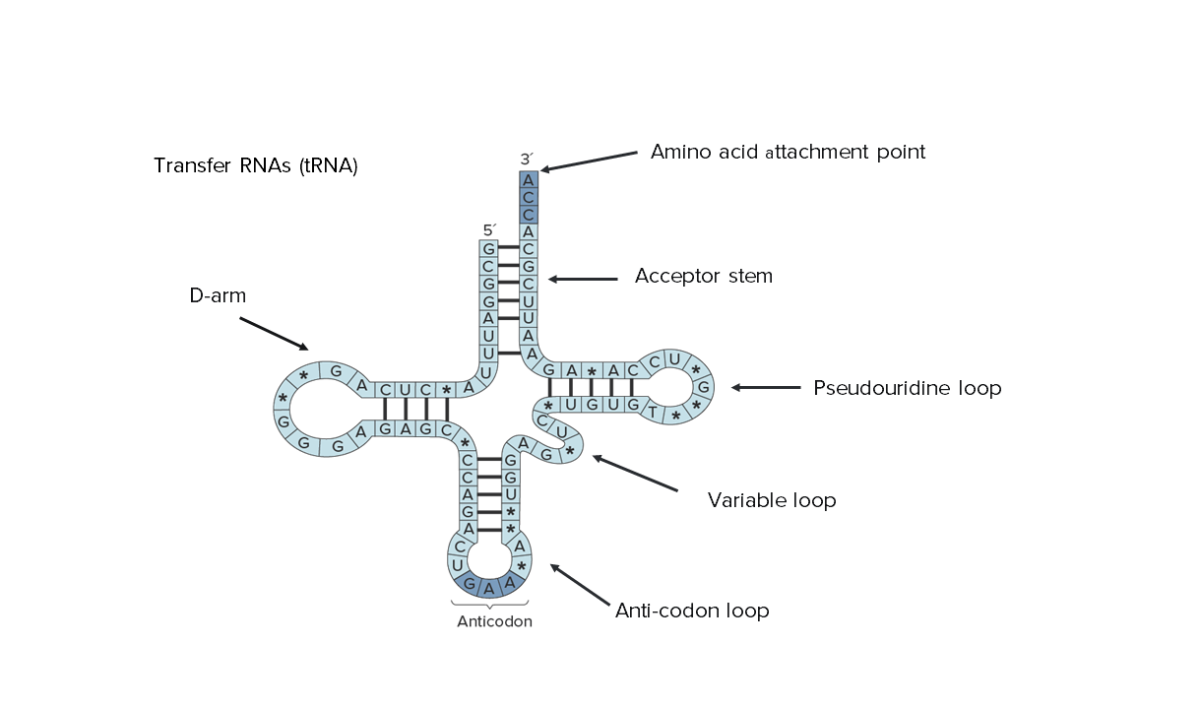
Estructura secundaria del ARN de transferencia (ARNt). Obsérvese que se puede ver toda su secuencia, lo que indica su tamaño reducido.
Imagen por Lecturio.
Carga de un ARNt en la aminoacil sintetasa
Imagen por Lecturio.Los ribosomas son complejos catalíticos que incluyen componentes proteicos y de ARNr. Dentro del complejo ribosomal, el ARNm es leído por los ARNt y se crea un polipéptido.
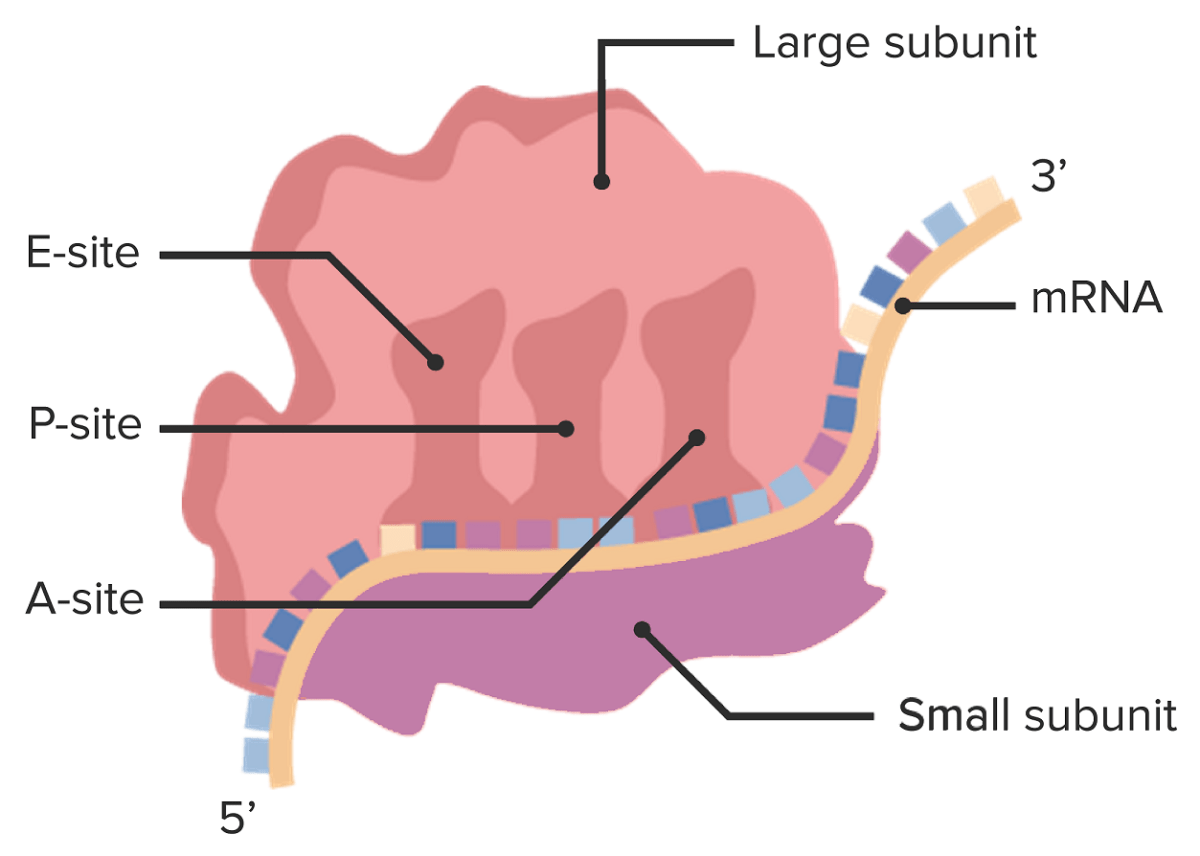
Estructura del ribosoma que muestra la subunidad grande en la parte superior, con los sitios de unión A, P y E para los ARNt cargados. La subunidad más pequeña está debajo del ARNm.
Imagen por Lecturio.| Procariotas | Eucariotas | |
|---|---|---|
| Tamaño de la subunidad pequeña | 30 S | 40 S |
| Tamaño de la subunidad grande | 50 S | 60 S |
| Número de proteínas | 52 | 88 |
| Número de ARNr | 3 | 4 |
| Tamaño de los ARNr homólogos en la subunidad pequeña | 16 S | 18 S |
| Tamaños de los ARNr homólogos en la subunidad grande |
|
|
| Tamaño del ARNr en la subunidad grande sin un homólogo procariota | 5,8 S |
El inicio de la traducción implica el ensamblaje del ribosoma en el ARNm en la dirección adecuada y la búsqueda del codón de inicio.
Una vez que la subunidad pequeña se ha unido al extremo 5′ del ARNm, la subunidad pequeña comienza a buscar el sitio de inicio.
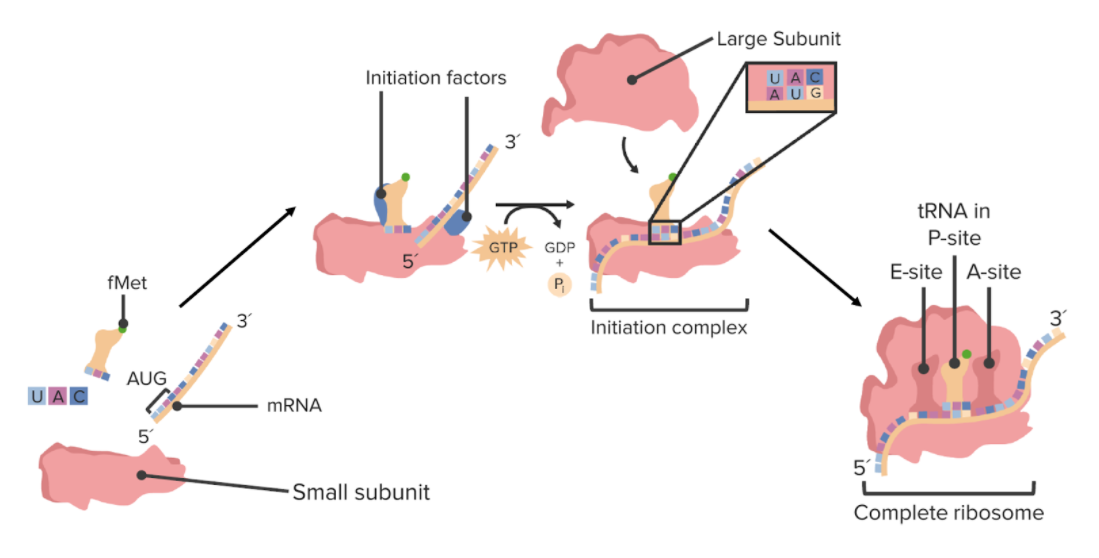
Ensamblado de un ribosoma
fMet: formilmetionina
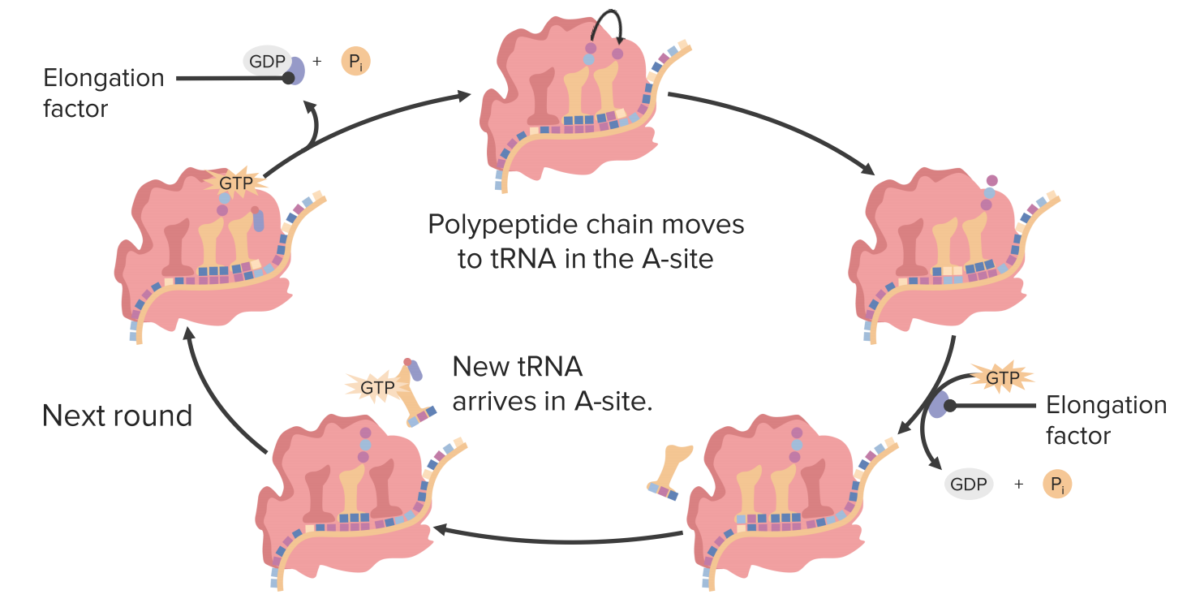
El ciclo de elongación
Imagen por Lecturio.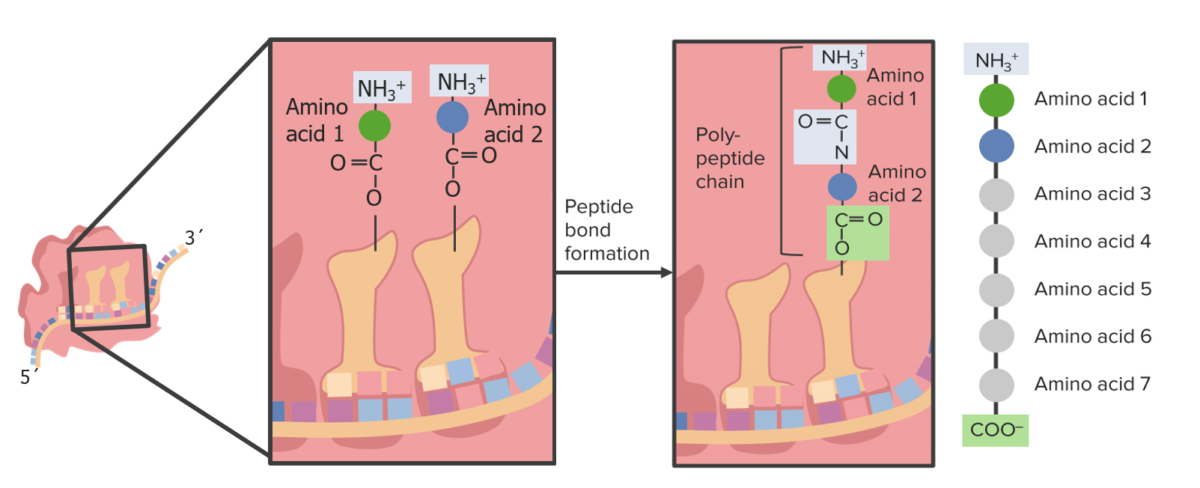
Se forma un enlace peptídico dentro del ribosoma.
Imagen por Lecturio.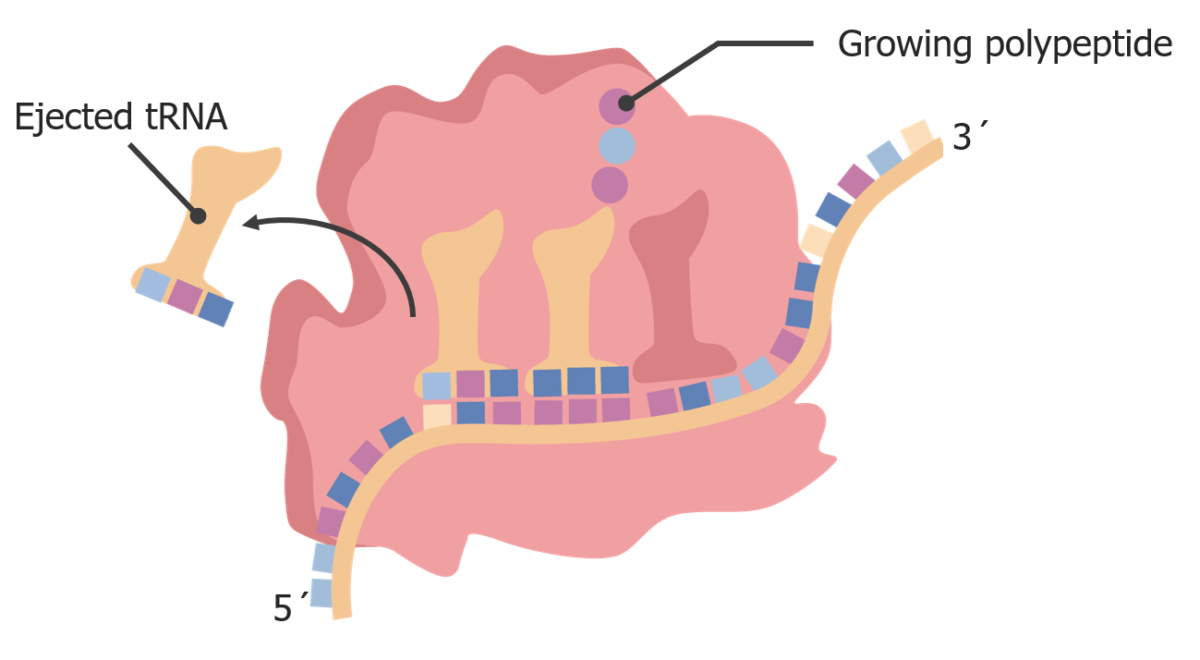
A medida que el ribosoma se transloca, el ARNt “vacío” se mueve hacia el sitio E y es expulsado del ribosoma.
Imagen por Lecturio.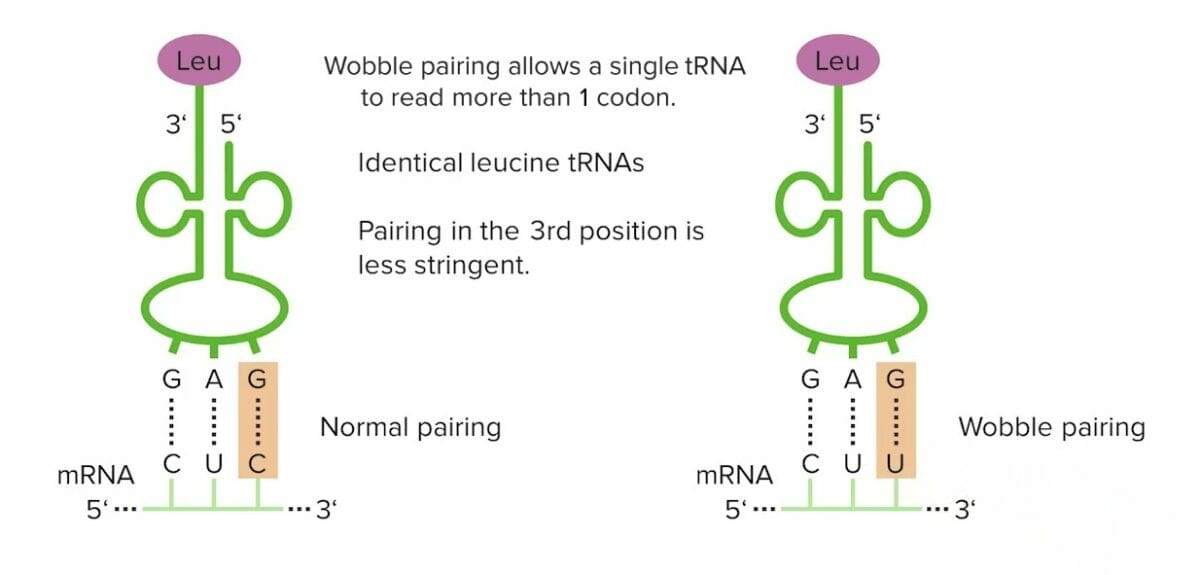
Emparejamiento de wobble
Imagen por Lecturio.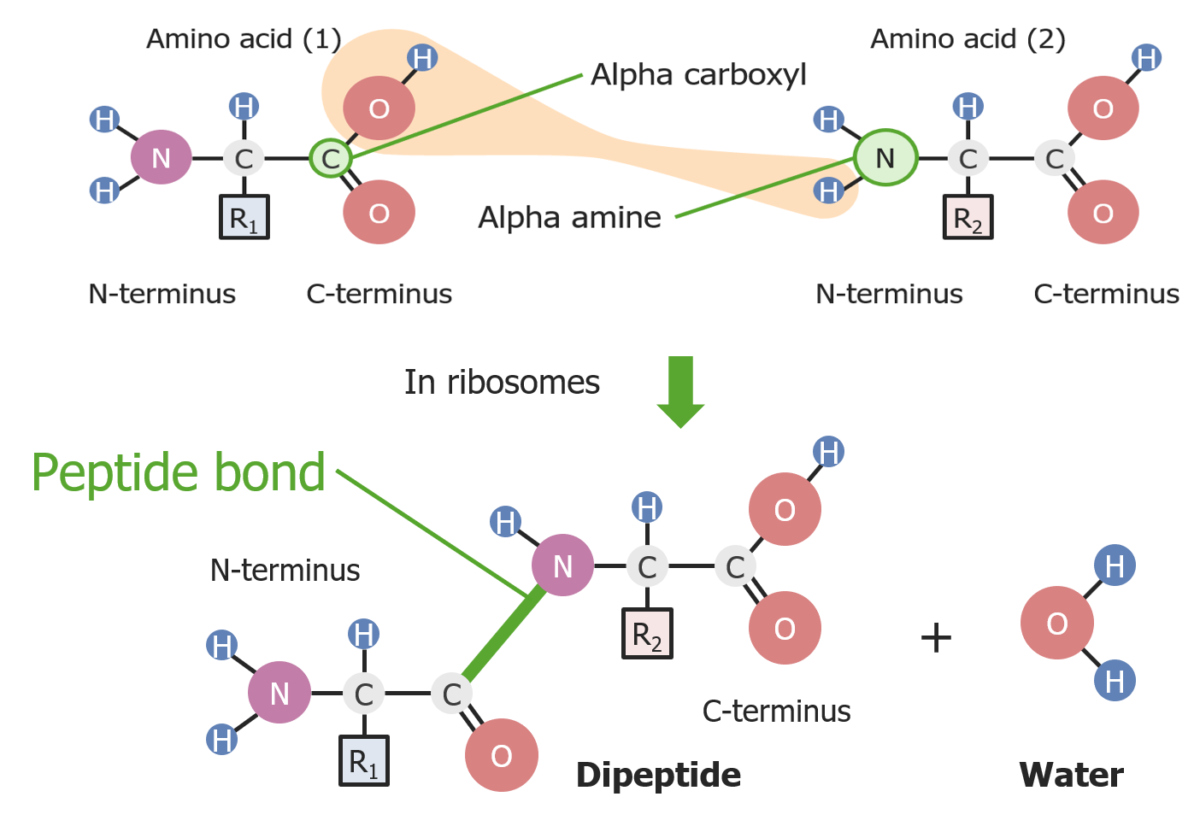
Formación de un enlace peptídico entre 2 aminoácidos
Imagen por Lecturio.La terminación se produce cuando el ribosoma alcanza un codón de parada.
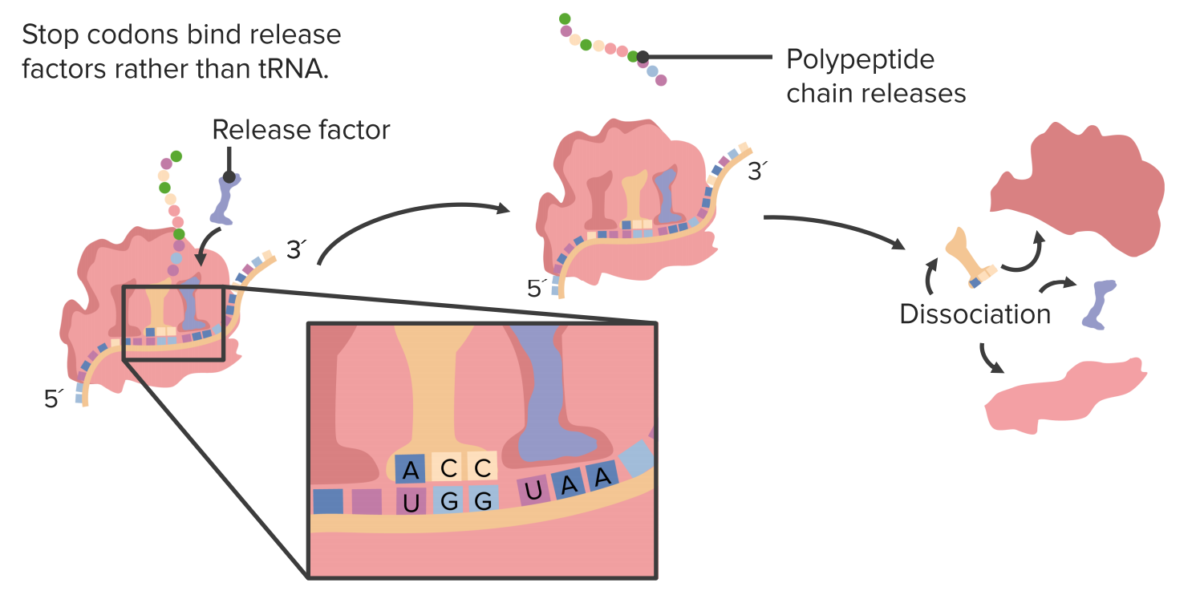
Finalización de la traducción
Imagen por Lecturio.La traducción puede regularse en la iniciación, elongación o terminación; principalmente a través de la regulación hacia arriba o hacia abajo de los factores de iniciación, elongación y terminación. La traducción se regula además mediante la interferencia del ARN, el empalme alternativo y la edición del ARN.
El ARN de interferencia (ARNi) es una interferencia en la traducción por parte de pequeñas moléculas de ARN de doble cadena que acaba inhibiendo la traducción de ARNm específicos.
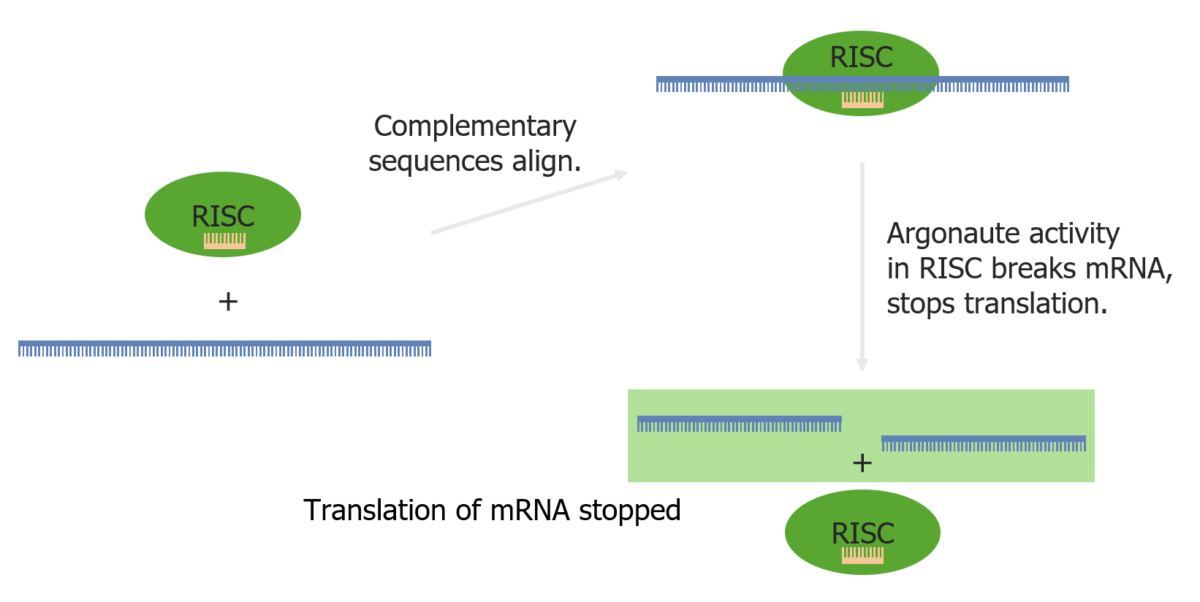
Interferencia de ARN a través del complejo de silenciamiento inducido por ARN y un miARN
Imagen por Lecturio.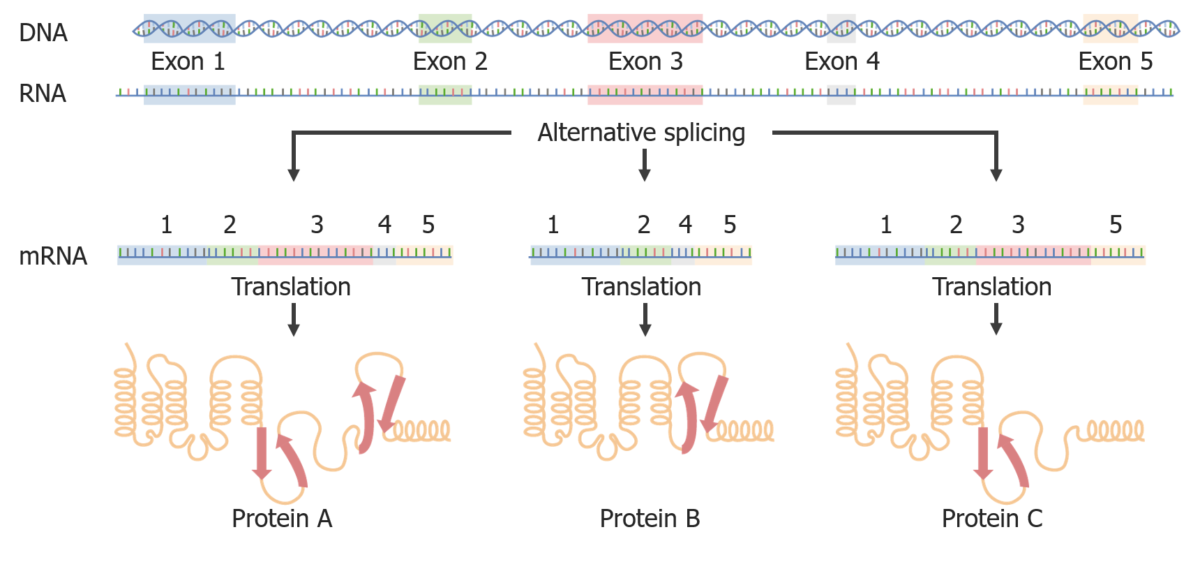
Empalme alternativo:
Al empalmar de diferentes maneras, se pueden crear diferentes proteínas a partir del mismo ARNm.