Playlist
Show Playlist
Hide Playlist
Perfect Enzyme and Lineweaver Burk Plot – Enzyme Classification
-
02 Advanced Enzymes&Kinetics2.pdf
-
Reference List Biochemistry.pdf
-
Download Lecture Overview
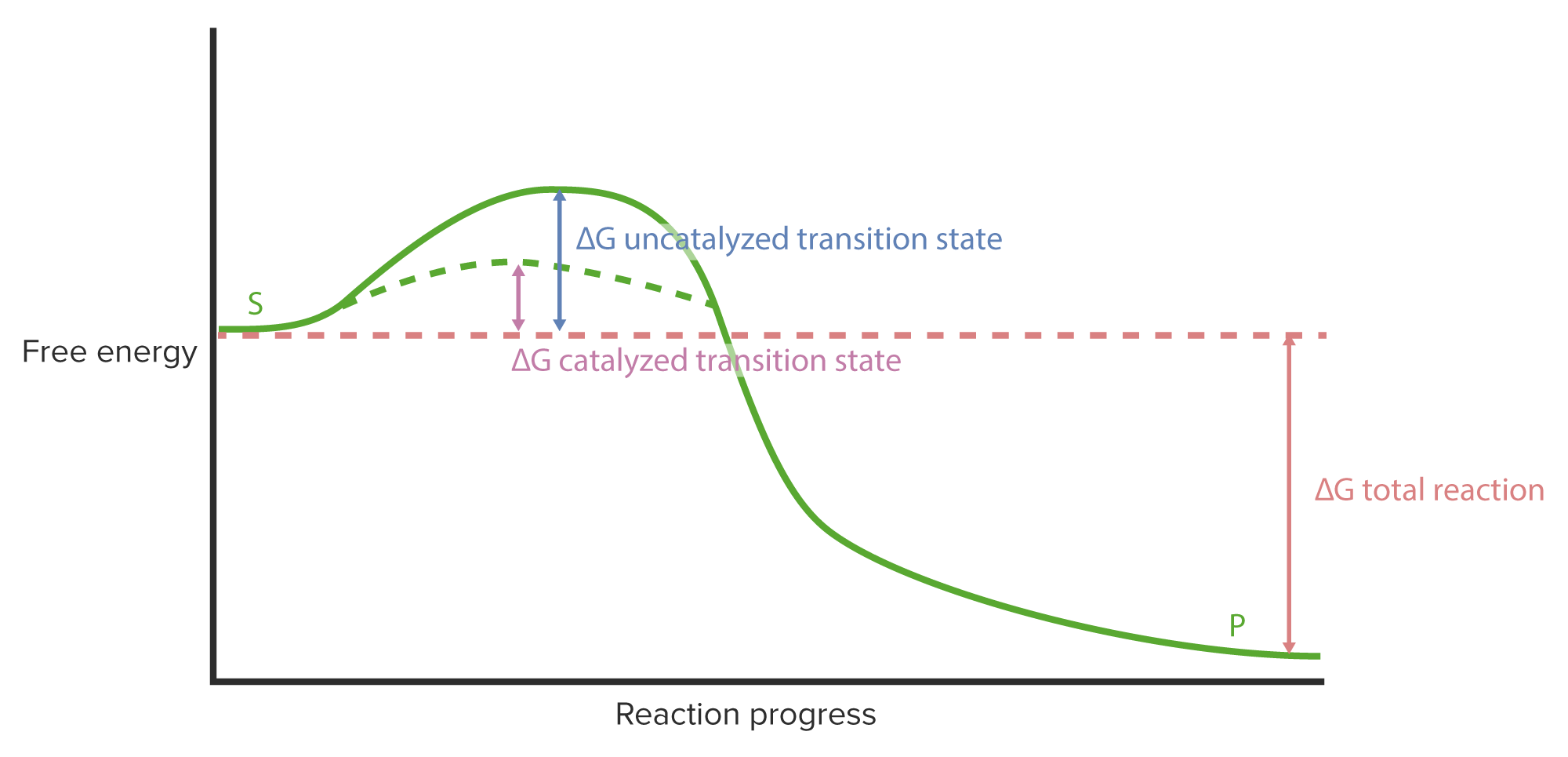
00:01 Die Idee von Kcat führt uns zu einer weiteren Sache, über die wir nachdenken müssen. 00:06 Enzyme sind wirklich bemerkenswert, okay? Wir haben gesehen, dass Enzyme Reaktionen um ein verblüffendes Vielfaches beschleunigen können. 00:13 Und wir haben hier auch das Konzept der Affinität eines Enzyms zu seinem Substrat eingeführt. 00:21 Die Frage, was ein perfektes Enzym bedeuten würde, beginnt, sich herauszukristallisieren: Was wäre ein perfektes Enzym? Ein perfektes Enzym wäre ein Enzym, das eine so hohe Geschwindigkeit wie möglich bei einer möglichst hohen Affinität zu seinem Substrat besitzen würde. Also ein Enzym, das, um die maximale Geschwindigkeit zu erreichen, nicht sehr viel Substrat benötigt; denn das Enzym würde sich das Substrat schnappen und es sehr bereitwillig in ein Produkt umwandelt. 00:48 Ein perfektes Enzym hätte also eine hohe Geschwindigkeit und eine niedrige Km. 00:54 Nun, wir verwenden Kcat als unser Maß für die Geschwindigkeit und Km als Maß für die Affinität zum Substrat. 01:02 Hohe Kcat bedeutet hohe Geschwindigkeit, niedrige Km bedeutet hohe Affinität. 01:10 Das perfekte Enzym hätte ein großes Verhältnis von Kcat zu Km. 01:15 Wenn wir diese beiden Parameter nehmen, sie durcheinander teilen und anfangen, Enzyme zu vergleichen, sehen wir, dass Enzyme sehr unterschiedliche Verhältnisse von Kcat/Km haben. 01:26 Wir sehen aber auch, dass es eine Art oberste Stufe gibt, jenseits derer dieses Verhältnis kaum noch ansteigt. Nun, diese Zahlen sind ein wenig unterschiedlich. Aber dies sind wirklich die Spitzenenzyme. 01:40 Ihre Kcat/Km-Verhältnisse unterscheiden sich nicht signifikant voneinander: Die Potenzwerte liegen bei 10 hoch 7, in einem Fall 10 hoch 9, aber meistens ungefähr bei 10 hoch 8. 01:49 Kein Enzym liegt zum Beispiel bei 10 hoch 15. 01:53 Warum ist das so? Nun, diese Enzyme haben ihre maximale Effizienz erreicht. 02:02 Sie können nicht noch effizienter werden. Es gibt zwei Dinge, die sie einschränken. 02:06 Erstens können sie nicht ihre Form oder ihre Aminosäure-Sequenz ändern, also zum Beispiel ein besseres aktives Zentrum schaffen als jenes, welches sie im Laufe der Evolution erhalten haben. 02:14 In diesem Sinne sind sie buchstäblich perfekt. 02:17 Mutationen, die dies verändern, bringen immer ein weniger effizientes Enzym hervor. 02:23 Es gibt eine Grenze für diese Art der Effizienz. Die zweite Sache ist wirklich interessant. 02:28 Es wird angenommen, dass der Grund für das Erreichen eines Maximums zusätzlich zu dem, was ich gerade erwähnt habe, der ist, dass es etwas anderes gibt, das die enzymatische Reaktion einschränkt. 02:38 Und der limitierende Faktor für diese Enzyme in einer Lösung ist eine gewisse Größe: Und zwar die Geschwindigkeit, mit der das Substrat sich in Wasser löst bzw. diffundiert. 02:49 Die Diffusion geschieht natürlich bei der Vermischung, die wir sehen. 02:52 Bei der Diffusion, die das Substrat in das aktive Zentrum des Enzyms bringt. 02:56 Und obwohl dieser Diffusionsprozess selbst in atemberaubender Geschwindigkeit ablaufen kann, limitiert er die Arbeit des Enzyms. 03:04 Diese Enzyme sind also so effizient, dass sie nur darauf warten, dass Wasser ihnen Substrat liefert. Das ist eine bemerkenswerte Sache. 03:13 Nehmen wir nun einige dieser kinetischen Parameter, über die wir gesprochen haben, und wenden sie an, um enzymatische Reaktionen zu verstehen. 03:22 Ich habe jetzt mehrmals die Auftragung von V0 gegen [S] gezeigt und wir haben gesehen, dass dies eine Hyperbel ist. 03:27 Und Sie haben in dieser Kurve gesehen, dass ganz an der Spitze der Kurve Vmax ist. 03:33 Und wenn ich diese Kurve ins Auge fasse, muss mich fragen: "Nun, habe ich Vmax an der richtigen Stelle eingezeichnet? Ist es ein bisschen weiter oben? Oder weiter unten?" Und ich muss dann eine Entscheidung fällen. 03:43 Ich hätte gerne eine präzisere Möglichkeit, Vmax zu verorten. 03:46 Nun, ein Trick oder Werkzeug, das wir benutzen können, ist die Änderung der Auftragung der Werte. 03:53 Anstatt V0 gegen die Substratkonzentration aufzutragen, d.h. die Geschwindigkeit in Abhängigkeit von der Substratkonzentration, nehme ich die gleichen Werte, die ich für das V/[S]-Diagramm hatte, und bilde den Kehrwert. Den Kehrwert aller Werte. Ich erzeuge also eine doppelt-reziproke Auftragung bzw. ein Lineweaver-Burk-Diagramm. Dies waren die Leute, die das erfunden haben. 04:16 Und wenn ich die Werte auf diese Weise umkehre, stelle ich fest, dass die Hyperbel zu einer Gerade wird. 04:22 In einer linearen Darstellung können wir viel einfacher interpretieren, bzw. festzustellen, wie hoch diese Werte sind. 04:28 Wenn ich eine solche doppelt-reziproke Auftragung vornehme, erzeuge ich eine lineare Darstellung. Ich kann eine Linie durch die Punkte ziehen und nun durch die Achsen extrapolieren, die y-Achse und die x-Achse. 04:45 Wenn ich das tue, erzeuge ich einen Schnittpunkt mit der y-Achse und dieser besitzt den Wert 1/Vmax. 04:52 Ich kann natürlich problemlos diesen Wert wieder umkehren und so Vmax erhalten. 04:56 Der Schnittpunkt mit der x-Achse liegt bei -1/Km. 05:01 Wenn ich -1 durch den Wert an dieser Stelle rechne, erhalte ich Km. Sehr schöne Darstellung: Lineweaver-Burk-Diagramm. Und es gibt noch andere Auftragungen. 05:11 Mit Hilfe von Lineweaver-Burk-Diagrammen kann ich sehr leicht Vmax und Km aus einer Reihe von Wertepaaren bestimmen.
About the Lecture
The lecture Perfect Enzyme and Lineweaver Burk Plot – Enzyme Classification by Kevin Ahern, PhD is from the course Enzymes and Enzyme Kinetics.
Included Quiz Questions
Which of the following is true of a perfect enzyme?
- It has a high Kcat and a low Km.
- It has a high Vmax and a high Km.
- It has a low Kcat and a high Km.
- It has a low Kcat: Km ratio.
Which of the following is true regarding a Lineweaver-Burk plot?
- The Km is the negative reciprocal of the value of the X-intercept.
- Vmax is equal to the value where the line crosses the Y-axis.
- The slope of the line is equal to Kcat/Km.
- Kcat is equal to the value of the X-intercept.
Customer reviews
4,5 of 5 stars
| 5 Stars |
|
1 |
| 4 Stars |
|
1 |
| 3 Stars |
|
0 |
| 2 Stars |
|
0 |
| 1 Star |
|
0 |
This lesson is explained very well! It's clear to me what Lineweaver-Burk plot means and how enzymes are most efficient when they have high Kcat/low Km
I finally understood why we have Lineweaver Burk Plot and how we read it.