Playlist
Show Playlist
Hide Playlist
Kinetic Considerations – Enzyme Catalysis
-
01 Advanced Enzymes&Kinetics1.pdf
-
Reference List Biochemistry.pdf
-
Download Lecture Overview
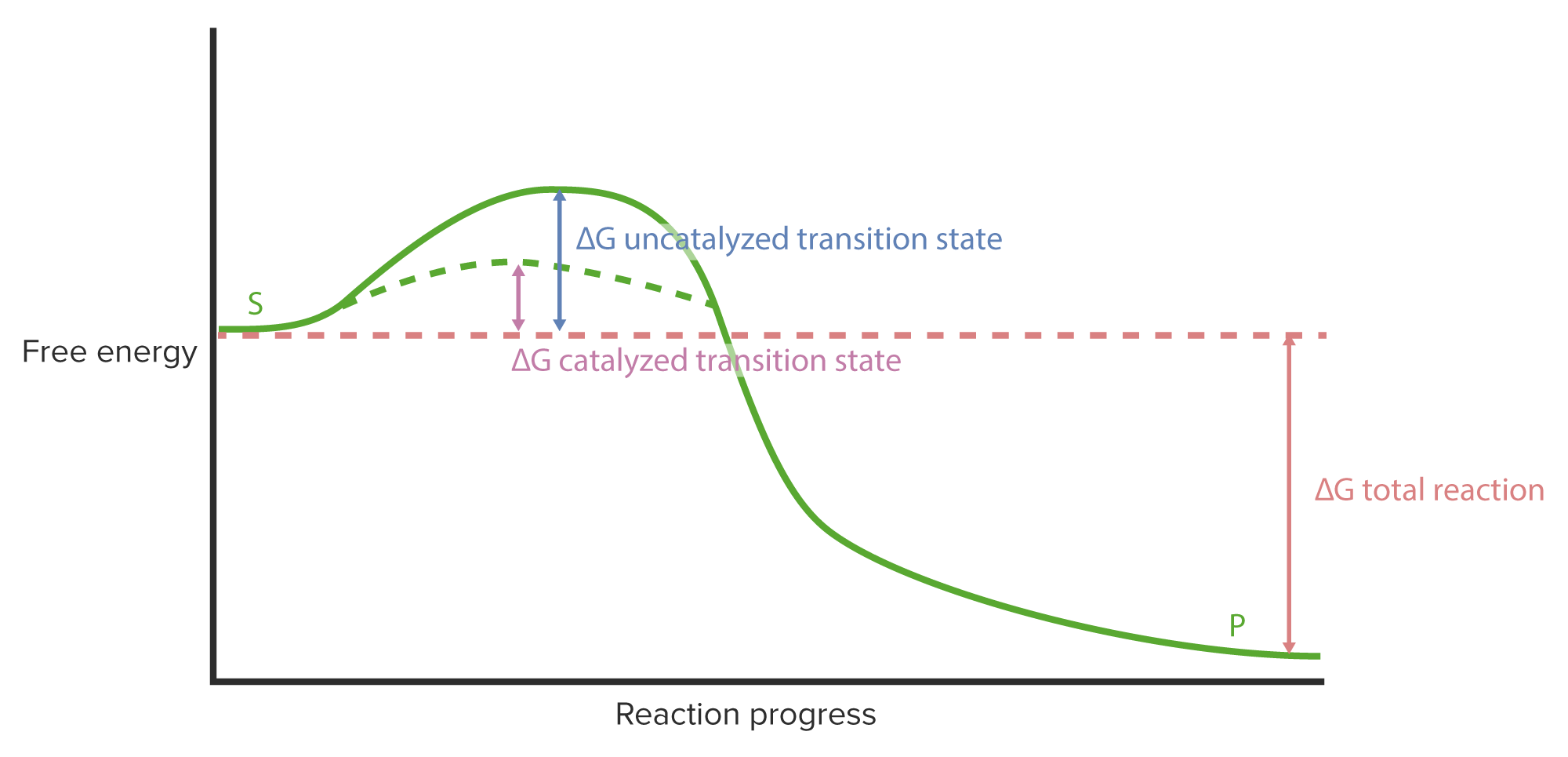
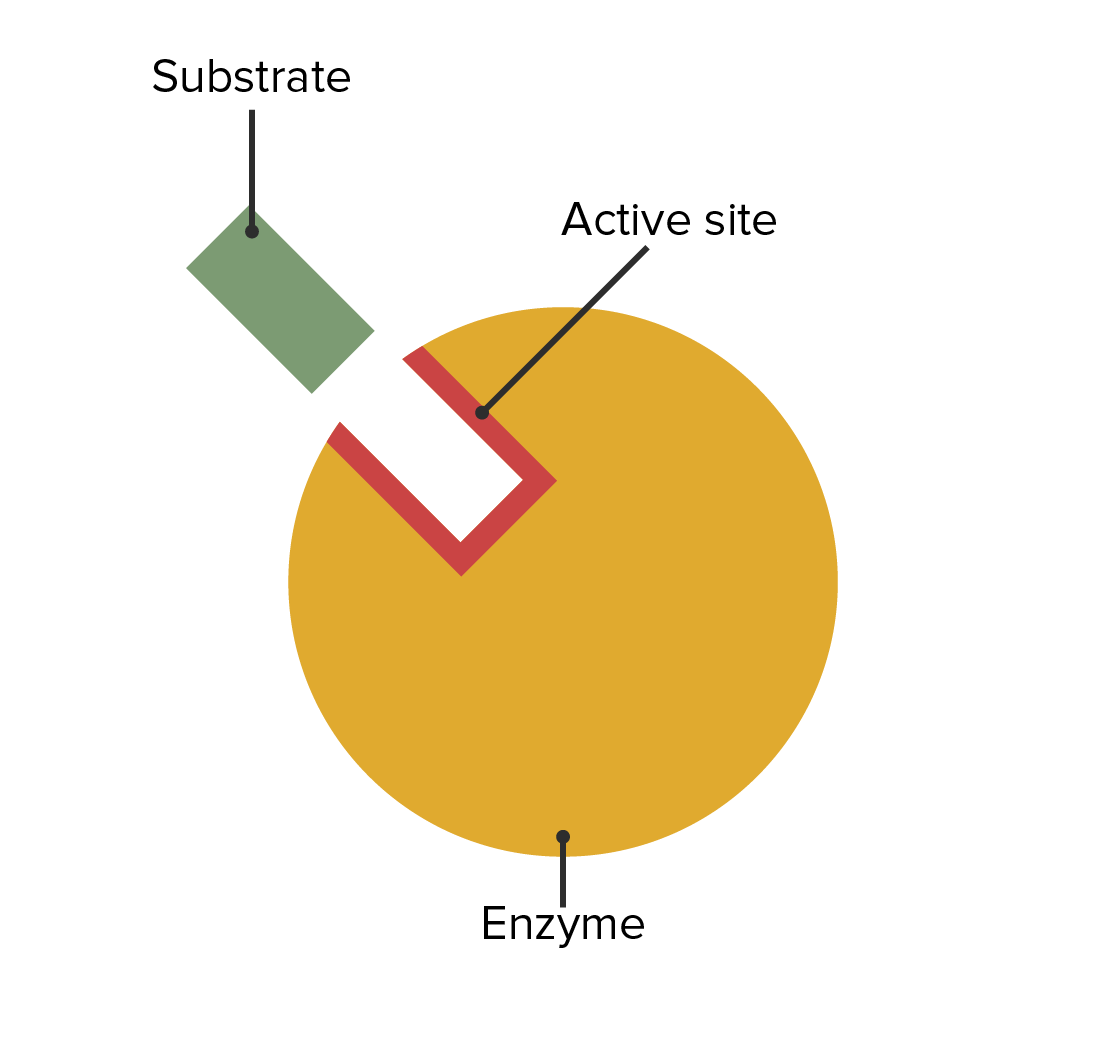
00:00 Als wir das Bild der ablaufenden Reaktion sahen, sahen wir die verschiedenen Zustände, die Sie auf dem Bildschirm sehen. 00:04 Das Enzym und das Substrat banden aneinander und bildeten den ES-Komplex, der sich bei der Veränderung des Enzyms in den ES*-Komplex umwandelte. 00:13 Dieser wiederum bildete den EP- bzw. Enzymprodukt-Komplex, was letztendlich zur Freisetzung des Enzyms und des Produkts führte. Jetzt komme ich darauf zurück, denn wir müssen etwas über die kinetischen Eigenschaften, d.h. die Geschwindigkeitsparameter der Reaktionen die wir untersuchen werden, sprechen. 00:32 Diese Geschwindigkeit der Entstehung von Produkten ist das, was uns wirklich interessiert. 00:37 Wenn wir darüber sprechen, wie schnell ein Enzym eine Reaktion ablaufen lassen kann, ist dies der Kern dessen, was wir ergründen wollen. Wir wollen wissen, wie schnell ein Enzym das schafft. 00:44 Nun, um dies zu tun, müssen wir einige einfache Annahmen festlegen. Im einfachen Fall nehmen wir an, dass der Enzym-Substrat-Komplex direkt in Enzym plus Produkt übergeht, okay? Wenn wir also diese obige kompliziertere Gleichung zur unteren Gleichung vereinfachen, können wir besser verstehen, was im Gesamtmechanismus vor sich geht. 01:07 Diese Konstanten hier werden nicht wirklich in unsere Betrachtungen eingehen. 01:13 Aber die kcat, die Sie hier beim Enzym, das zu E plus P umgewandelt wird, sehen, wird in der Tat eine wichtige Überlegung für uns sein, wenn wir über die kinetischen Parameter sprechen. 01:24 Die kcat ist, wie wir sehen werden, die Geschwindigkeit, mit der das Produkt gebildet wird. 01:26 Betrachten wir nun, was in einigen verschiedenen Szenarien einer Reaktion passiert. 01:35 Wir können uns zum Beispiel vorstellen, dass wir ein Enzym haben, dargestellt in gelb. Und wir haben dort Substrate als kleine rote Kugeln. 01:43 Wir können zunächst einmal eine Situation haben, in der eine Reaktion unter der Bedingung von wenig Substrat abläuft. 01:48 Und wenn wir eine geringe Menge Substrat in einer Lösung haben, können wir uns vorstellen, dass sehr wenige Enzyme ein Substrat binden werden; denn, die Chancen, auf ein Substrat zu stoßen, sind geringer. 02:00 In der Mitte haben wir einen Zwischenzustand, in dem wir eine etwas höhere Substratkonzentration haben als vorher. 02:05 Hier sehen wir, dass mehr Enzymmoleküle gebunden und an der Herstellung des Produkts beteiligt sind. Und das dritte Szenario, das wir uns vorstellen können, ist eine hohe Substratkonzentration. 02:17 Und in einer Situation mit viel Substrat bemerken wir, dass jedes Enzym an ein Substrat gebunden ist. 02:27 Und das ist wichtig, denn bei hohen Substratkonzentrationen sind diese Enzyme mit Substrat "gesättigt". 02:33 Das bedeutet: Sobald das Enzym an ein Substrat gebunden hat, es ein Produkt hergestellt und freigesetzt hat, greift es sich fast augenblicklich ein anderes Substrat. Es sitzt nicht herum und wartet auf irgendwas. 02:46 Nun, Enzyme haben interessanterweise einige kinetische Aspekte, die wir hier natürlich untersuchen wollen. 02:56 Aber wir sehen jetzt zum ersten Mal einen Entwurf der Arbeitsweise eines Enzyms. Ich muss einige Dinge in diesem Graphen erklären. 03:03 Zunächst einmal: Wir stellen in diesem Diagramm eine Reaktion dar. Das heißt: Wir tragen die Reaktionsgeschwindigkeit auf der y-Achse gegen die Substratkonzentration, die für die Reaktion verwendet wird, auf der x-Achse auf. 03:17 Jetzt sehen Sie, dass das V eine kleine 0 darunter hat. Die 0 darunter werde ich später erklären. Aber dies ist die sogenannte Anfangsgeschwindigkeit. Die Geschwindigkeit einer Reaktion wird anhand der Konzentration des hergestellten Produkts, geteilt durch die Zeit, ermittelt. Wir messen Konzentration in molar, millimolar, mikromolar, etc. 03:42 Also ergibt sich eine gewisse Stoffmengenkonzentration pro Zeit. So wird die Reaktionsgeschwindigkeit gemessen. 03:47 Die Substratkonzentration variiert, denn, um eine Kurve wie diese zu erzeugen, betrachte ich nicht nur eine Reaktion, sondern eine Reihe von Reaktionen. 03:55 Ich stelle Ihnen diesen Ansatz mal vor. Wir könnten uns zum Beispiel vorstellen, dass ich 20 Reaktionen ansetze, in 20 verschiedenen Reagenzgläsern. Ich möchte die Reaktionsgeschwindigkeit in jedem dieser Reagenzgläser messen. 04:07 Dafür gebe ich in jedes dieser Reagenzgläser einen Puffer. 04:14 Ich gebe das Substrat sowie das Enzym hinzu. 04:18 Wenn ich nun ein Experiment durchführe, möchte ich eine einzige Variable haben; denn ich möchte nur eine Sache manipulieren und deren Auswirkungen dann messen. 04:29 Die Variable, die ich hier habe, ist die Substratkonzentration. Ich habe in jedem Röhrchen die gleiche Menge Enzym verwendet. 04:34 Alle 20 Röhrchen haben die gleiche Menge Enzym. Sie enthalten alle die gleiche Menge Puffer, aber sie haben unterschiedliche Mengen Substrat, von kleinen Mengen bis hin zu sehr großen Mengen. 04:46 Jede dieser Reagenzgläser lasse ich über genau die selbe Zeit reagieren und dann messe ich die Menge des Produkts. 04:54 Auf diese Weise sehe ich die Auswirkung der Änderung des Substrats auf die Geschwindigkeit, und dann zeichne ich es auf. 05:02 Auf dem Bildschirm sehe Sie die Summe dieser Aufzeichnungen. Das heißt, jeder Punkt auf dieser Kurve stammt aus einer Reihe von abgelaufenen Reaktionen. 05:09 Und jede dieser Einzelreaktionen hat eine bestimmte Substratkonzentration und eine bestimmte Geschwindigkeit, die erreicht wurde. Nun, kaum überraschend, was sehen wir dann hier? Nun, ganz links sind wir bei niedriger Substratkonzentration. Wie hoch ist die Geschwindigkeit? Sie ist sehr niedrig. 05:25 Und genau das habe ich auf der vorigen Abbildung gezeigt. 05:29 Niedrige Substratkonzentration: das Enzym sitzt da und wartet auf Substrat. 05:36 Da wird es keine hohe Reaktionsgeschwindigkeit geben. 05:37 Bei hohen Substratkonzentrationen, wie ich sie auf der rechten Seite des Bildschirms sehe, habe ich eine hohe Geschwindigkeit. Das ergibt Sinn. Okay. Wenig Substrat - niedrige Geschwindigkeit; Viel Substrat - hohe Geschwindigkeit. Ich möchte, dass Sie sich das merken. 05:49 Jetzt zeige ich Ihnen ein weiteres Diagramm, um Ihnen ein Prinzip einer Reaktion zu veranschaulichen. 05:54 Auf der y-Achse habe ich die Konzentration des Produkts. Wir können uns das wiederum als Reaktionsgeschwindigkeit vorstellen. 05:59 Aber auf der x-Achse zeichne ich jetzt die Reaktionszeit ein. 06:03 Ich kann nun eines der Röhrchen nehmen, die ich im vorigen Beispiel verwendet habe. Und mir zum Beispiel anschauen, wie schnell das Produkt angehäuft wird und was mit diesem Produkt im Laufe der Zeit passiert. 06:15 In diesem Diagramm sehen wir, dass im Anfangsbereich der Reaktion ein lineares Verhältnis zwischen der Herstellung des Produkts und der Zeit besteht, okay? Aber nach einer Weile flacht die Kurve ab. 06:29 Das bedeutet: Die Reaktion bleibt über die Zeit nicht ewig linear. Und der Grund dass sie nicht ewig linear bleibt? Denken Sie daran: Enzyme katalysieren reversible Reaktionen. Je mehr Produkt sich also ansammelt, desto größer ist die Wahrscheinlichkeit, dass das Produkt wieder zurück in Substrat umgewandelt wird. 06:50 Nun, das ist eigentlich nicht das, was uns interessiert. Wir wollen untersuchen, wie schnell das Enzym Produkt herstellt. 06:56 Wenn wir also eine enzymatische Reaktion untersuchen wollen, müssen wir die sogenannte Anfangsgeschwindigkeit betrachten. 07:03 Wir wollen nicht zu lange warten, um die Produktkonzentration zu untersuchen. Denn wenn wir zu lange warten, untersuchen wir die umgekehrte Reaktion, und das ist nicht unser Ziel. 07:13 Deshalb benutzen wir Vo, also die Anfangsgeschwindigkeit in unseren Messungen. Okay.
About the Lecture
The lecture Kinetic Considerations – Enzyme Catalysis by Kevin Ahern, PhD is from the course Enzymes and Enzyme Kinetics.
Included Quiz Questions
Kcat in an enzymatic reaction refers to what?
- The rate of formation of the product.
- The rate of formation of the enzyme-substrate complex.
- The rate of formation of the enzyme-product complex.
- The rate of disappearance of product from the reaction mixture.
- The rate of backward reaction.
With time, the linear curve of a graph showing the relation between time and product concentration of an enzymatic reaction starts flattening. What can be the cause of the flattening?
- At the equilibrium state, the concentrations of the product and the reactant do not change.
- The longer an enzymatic reaction goes, the less the reverse reaction from product to substrate occurs.
- The enzyme gets tired of working over and over with the substrate molecules.
- The enzyme undergoes conformational changes, so it is unable to bind to the substrate anymore.
- The enzyme starts to build up.
In enzyme catalysis, which of the following is true?
- The velocity of a reaction is related to the concentration of the substrate used.
- There is an inverse relationship between substrate concentration and reaction velocity.
- The velocity of a reaction is unrelated to enzyme concentration.
- The reverse reaction does not occur.
Customer reviews
5,0 of 5 stars
| 5 Stars |
|
2 |
| 4 Stars |
|
0 |
| 3 Stars |
|
0 |
| 2 Stars |
|
0 |
| 1 Star |
|
0 |
This lecture provided me with so much clarity. Thank you
I really like the video, makes medical biochemistry easier to understand