Playlist
Show Playlist
Hide Playlist
Catalysis Considerations – Enzyme Classification
-
02 Advanced Enzymes&Kinetics2.pdf
-
Reference List Biochemistry.pdf
-
Download Lecture Overview
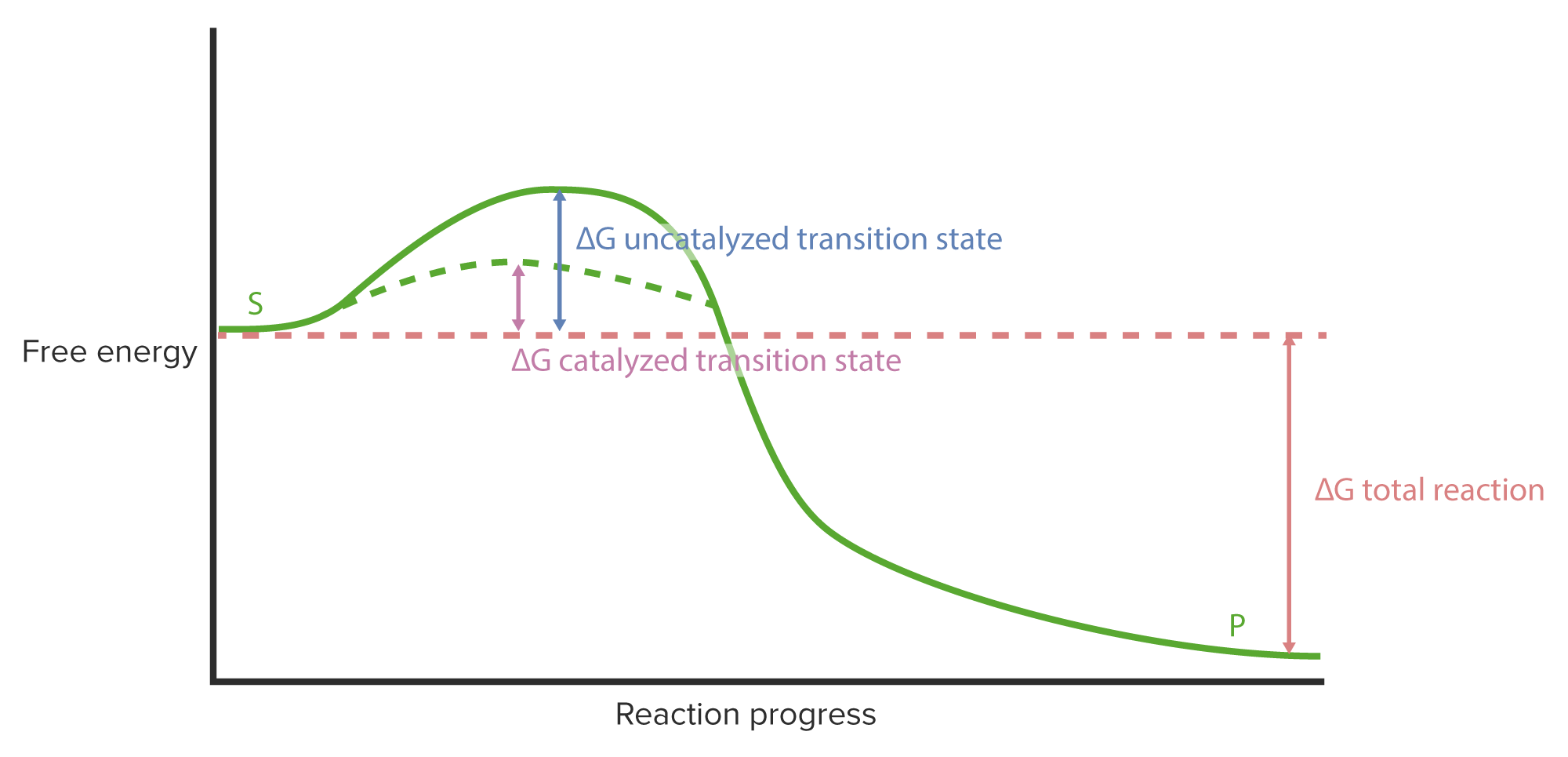
00:00 Ich habe bisher beschrieben, wie flexibel Enzyme um das aktive Zentrum herum sind und wie diese Flexibilität am aktiven Zentrum den katalytischen Prozess erleichtert. 00:09 Aber Enzyme sind überall flexibel. 00:11 Und diese Rund-Um-Flexibilität verleiht dem Enzym einige interessante Eigenschaften in Bezug auf seine Aktivität. 00:17 Jetzt sehen wir hier links ein Enzym, das sich bereit macht, ein Substrat zu binden, wie wir bereits gesehen haben. 00:22 Und auf der rechten Seite sehen wir das Enzym, wie es sich nach der Bindung des Substrats an dessen Form angepasst hat. Das ist der "Induced Fit", den ich schon einmal angesprochen hatte. 00:31 Diese induzierte Anpassung ist sehr sinnvoll für das aktive Zentrum, wie ich schon sagte. 00:36 Aber auch der Rest des Enzyms ist von diesen Wechselwirkungen betroffen. 00:41 Tatsächlich manifestiert sich dies im Diagramm, das in dieser Abbildung hier gezeigt wird. 00:45 In diesem Diagramm sehen wir die V/[S]-Kurve für ein Enzym, das allosterisch ist. 00:51 Ich erinnere Sie daran, dass allosterisch bedeutet, dass das Enzym mit einem kleinen Molekül interagiert und seine Aktivität beeinträchtigt wird. 00:58 In diesem Fall ist das kleine Molekül, das mit ihm interagiert sogar gleichzeitig sein Substrat. 01:05 Dies geschieht bei Enzymen mit mehreren Untereinheiten. Was ich jetzt beschreiben werde, ähnelt dem, worüber ich bereits gesprochen habe: der Bindung von Sauerstoff durch Hämoglobin, in einer anderen Präsentation. 01:16 Wenn Hämoglobin an Sauerstoff bindet, können Sie sich vielleicht erinnern, dass sich die Bindung änderte, wenn die Sauerstoffkonzentration zunahm. 01:24 Mit steigender Sauerstoffkonzentration stieg die Affinität des Hämoglobins für Sauerstoff von niedrig auf hoch und das war wichtig für die Wirkung von Hämoglobin. 01:33 Das Gleiche kann mit einem Enzym passieren: Seine Affinität kann sich in Bezug auf die Bindung des Substrats, das es allosterisch beeinflusst, ändern. 01:44 Bei Enzymen mit mehreren Untereinheiten geschieht dies, weil ein Teil des Enzyms sein Substrat bindet und so die Bindung des Substrats an andere Teile des Enzyms beeinflusst. 01:54 Diese Veränderung, die ich Ihnen beschrieben habe, führt zu einer Änderung der gesamten physischen Form des Enzyms, nicht nur des katalytischen Zentrums. 02:02 Diese allgemeine Veränderung des Enzyms wird unterschiedlich bezeichnet. Zunächst einmal sprechen wir von einem Zustand, der entspannt ist. 02:08 Das nennt man den R-("relaxed")-Zustand. Der entspannte Zustand eines Enzyms ist der Zustand, in dem das Enzym wirklich offen für die Bindung von Substrat ist, und es das Substrat auch sehr gut binden kann. 02:19 Der entspannte Zustand eines Enzyms entspricht einem aktiveren Zustand des Enzyms. 02:24 Im Gegensatz dazu ist beim T-Zustand eines Enzyms, wobei T für tense ("gespannt") steht, das Enzym angespannt. Es ist fest. Es ist nicht flexibel, und es kann nicht so gut Substrat binden. 02:36 In diesem Diagramm beispielsweise können wir sehen, dass sich das Enzym bei niedrigen Substratkonzentrationen im T-Zustand befindet. 02:42 Es bindet das Substrat nicht sehr gut. Aber sobald die Substratkonzentration hoch genug ist, dreht sich das Ganze um. 02:49 Das Enzym kann dann das Substrat besser binden. Die Geschwindigkeitsänderung kehrt sich also um. Wir sehen nicht mehr die Hyperbel, die wir vorher gesehen haben. 02:57 Es gibt mehrere Erklärungsansätze für dieses Phänomen. 03:02 Ich möchte also ein wenig Zeit damit verbringen, das durchzugehen und zu erklären wie wir diese Veränderung interpretieren. 03:08 Man nennt sie das konzertierte Modell und das sequentielle Modell. 03:11 Über das erste dieser Modelle, das konzertierte Modell, werde ich zuerst sprechen. 03:15 Das konzertierte Modell ist etwas schwer zu verstehen. 03:19 In diesem Modell sehen wir das Enzym in zwei Zuständen, und zur Veranschaulichung nehmen wir an, dass dieses Enzym vier Untereinheiten hat. 03:28 Enzyme können sehr sehr viele Untereinheiten haben, manchmal bis zu mindestens einem Dutzend Untereinheiten. In dieser Abbildung sind es jedoch vier. 03:36 Im T-Zustand haben wir das Enzym in den Quadraten oben. Der T-Zustand ist der ungünstigste Zustand. 03:45 Die Kreise unten beziehen sich auf das Enzym im R-Zustand, also wo das Enzym entspannt ist und wahrscheinlicher Substrat binden kann. 03:52 Das konzertierte Modell besagt, dass das Umschalten zwischen dem T-Zustand und dem R-Zustand genau so geschieht wie hier gezeigt: Wir gehen von oben nach unten, und es gibt keine Zwischenschritte. 04:06 Dieses Modell erscheint etwas kontra-intuitiv; denn es besagt, dass das Umschalten von T auf R nicht durch die Bindung des Substrats verursacht wird; Sondern der R-Zustand bzw. T-Zustand wird jeweils vom Substrat bevorzugt. 04:27 Wenn ich also ein Enzym habe, das in den R-Zustand übergeht und Substrat bindet, wird das Substrat es im R-Zustand fixieren. 04:35 Es wird also eher im R-Zustand bleiben und folglich reaktiver sein. 04:41 Wenn das Enzym im T-Zustand sein Substrat bindet, wird es im T-Zustand bleiben. 04:45 Sobald das Enzym im R-Zustand ist, bleibt es dort und produziert immer weiter, und da der R-Zustand mehr und mehr von dem Produkt herstellt, wird alles, was den R-Zustand begünstigt oder fixiert, die Reaktion stärker begünstigen. 04:58 Das konzertierte Modell funkioniert also nach dem Prinzip "Alles oder Nichts". Aber die Fixierung des einen Zustands ist zentral für dieses Modell. 05:08 Sie können hier sehen, dass es ein Gleichgewicht zwischen den beiden gibt, und das Gleichgewicht verschiebt sich, wenn mehr Substrat bindet oder die Enzyme in einem bestimmten Zustand fixiert werden. 05:18 Wenn wir weiter nach rechts gehen, wird der R-Zustand bevorzugt; denn, es gibt jetzt mehr Enzyme in diesem R-Zustand, und mehr Enzym bedeutet mehr Produkt. 05:28 Der R-Zustände können, wie gesagt, umschlagen, unabhängig voneinander, aber der gebundene Zustand begünstigt in diesem Fall den R-Zustand. 05:38 Das andere Modell, also das sequenzielle Modell, ist dem Umklappen oder der Veränderung des Hämoglobins sehr ähnlich. 05:47 Wir beziehen uns auch auf die Zustände, R-Zustand und T-Zustand, bei Hämoglobin aber wir verwenden dies häufiger in Bezug auf Enzyme. 05:55 In diesem Modell haben wir nun ein Enzym, das im T-Zustand anfängt. 05:59 Das sind die vier Quadrate auf der linken Seite. 06:04 Die Bindung des ersten Substrats bewirkt, dass eine der Untereinheiten des Enzyms umklappt. 06:09 Und das ist in blau dargestellt in der zweiten Figur von links. 06:13 Wenn dieses Umklappen stattfindet, interagiert das Blau mit den beiden anderen Untereinheiten des Enzyms und wir können sehen, dass die beiden lila werden und sich abrunden. 06:23 Das bedeutet, dass sich der blaue Kreis, der sich im R-Zustand befindet, auf die beiden Untereinheiten drumherum auswirkt und sie ebenfalls in den R-Zustand versetzt. 06:35 Nun, dieses Umklappen begünstigt die Bindung von mehr Substrat und so können wir dann nacheinander sehen, dass das Blau immer dominanter wird, je weiter wir nach rechts kommen. 06:45 Die Bindung von Substrat ist entscheidend für dieses Enzym; denn die Bindung des Substrats verursacht in diesem Modell das Umklappen. 06:55 Wenn wir so im Alltag darüber sprechen, sagen wir oft "Nun, dies bewirkt, dass das Enzym dies oder jenes tut", und wenn wir das sagen, ist das eigentlich zu lasch. 07:03 In diesem Fall verursacht der Auslöser physisch das Umklappen. 07:08 Beim konzertierten Modell ist der Auslöser keine direkte, sondern eine indirekte Folge der Fixierung, die ich beschrieben habe. 07:14 Der entscheidende Unterschied zwischen dem konzertierten Modell und dem sequenziellen Modell ist der Auslöser, den ich erwähnt habe. 07:21 Der Auslöser des Umklappens passiert physisch. 07:25 Die beiden Modelle, die ich gerade beschrieben habe, das konzertierte Modell und das sequenzielle Modell, sind genau das. Sie sind nur Modelle, um zu erklären, wie der T-Zustand und der R-Zustand in Enzymen zustande kommen. 07:36 Es ist sehr wahrscheinlich, dass kein Enzym ausschließlich das eine oder das andere benutzt und es gibt eine Menge Beweise dafür, dass Enzyme eine Art Mischung aus diesen beiden Modellen verwenden.
About the Lecture
The lecture Catalysis Considerations – Enzyme Classification by Kevin Ahern, PhD is from the course Enzymes and Enzyme Kinetics.
Included Quiz Questions
Which of the following occurs in the concerted model?
- R/T flipping occurs independently of the binding of substrate.
- The binding of the substrate causes the enzyme to flip the T/R state.
- The R-state is favored.
- The binding of allosteric effector(s) causes the enzyme to flip states.
Which of the following occurs in the sequential model of catalysis?
- The binding of substrate molecules causes the enzyme to flip T/R states.
- The flipping occurs independently of the binding of the substrate.
- The R-state is favored.
- The binding of the product(s) causes the enzyme to flip states.
Allosteric regulation of enzyme activity involves which of the following?
- Conformational changes in the enzyme by the binding of effector molecules.
- Amino acid sequence changes in the enzyme by the binding of effector molecules.
- Formation of new phosphodiester bonds in the enzyme by the binding of effector molecules.
- Formation of new peptide bonds in the enzyme by the binding of effector molecules.
- Peptide bond breakage in the enzyme by the binding of effector molecules.
Which of the following statements is NOT true?
- According to the concerted model, the binding of substrates favors the equilibrium towards the T state of the enzyme.
- According to the concerted model, an enzyme exists in two states: R-state and T-state.
- The concerted model and sequential model explain the allosteric regulation of enzymes.
- The sequential model states that binding of the substrate to the enzyme subunit facilitates the change of T form to R form.
- In the concerted model, the conformations of all the subunits change simultaneously.
Customer reviews
5,0 of 5 stars
| 5 Stars |
|
1 |
| 4 Stars |
|
0 |
| 3 Stars |
|
0 |
| 2 Stars |
|
0 |
| 1 Star |
|
0 |
It is very clearly and enthusiastically explained. You make Biochem easy to understand.