As células T, também conhecidas como linfócitos T, são componentes importantes do sistema imunológico adaptativo. A sua produção inicia-se a partir das células-tronco hematopoiéticas na medula óssea, das quais surgem as células progenitoras de células T. Estas células migram para o timo para posterior maturação. Uma célula T madura funcional desenvolve-se a partir de um processo gradual: é formado um recetor de célula T (TCR, pela sigla em inglês), que seleciona células T com determinada afinidade para autoantigénios associados a moléculas de maior histocompatibilidade (seleção positiva) e que expressam CD4 ou CD8. Nesta fase, as células predispostas à autoimunidade sofrem apoptose (seleção negativa). De seguida as células T naive maduras são libertadas no timo e circulam até aos órgãos linfoides secundários para serem ativadas. A ativação ocorre quando estão presentes dois sinais (responsáveis por desencadear uma resposta imune): ligação específica do antigénio ao TCR e co-estimulação. Nas células T CD8+ é necessária estimulação adicional de citocinas. A célula T madura indiferenciada (Th0) desenvolve-se em células com diferentes funções, dependendo das citocinas a que são expostas durante a estimulação antigénica: As células CD4+ tornam-se células T auxiliares (Th) e as células CD8+ tornam-se células citotóxicas ou citolíticas. As células Th diferenciam-se noutros subtipos; os mais conhecidos são Th1, Th2, Th17, células Th foliculares e células T reguladoras. Outros tipos incluem células T natural killer e células T de memória. As células T diferenciadas maduras garantem uma resposta imediata e eficaz a agentes patogénicos, células tumorais e tecidos estranhos e fornecem memória imunológica.
Última atualização: Aug 1, 2022
O processo inicial ocorre no córtex externo do timo e as células movem-se para o córtex mais profundo à medida que amadurecem.
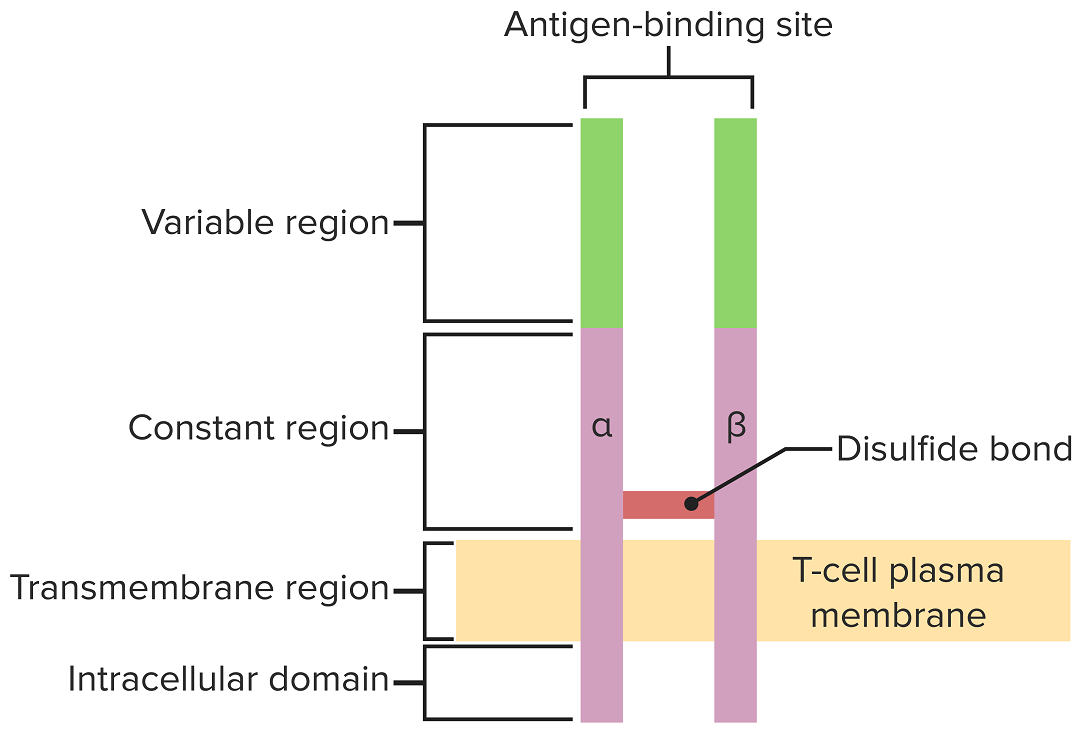
O recetor de células T atravessa a membrana citoplasmática e projeta regiões de ligação variáveis no espaço extracelular para ligar antigénios processados associados a moléculas MHC I ou MHC II.
Imagem por Lecturio.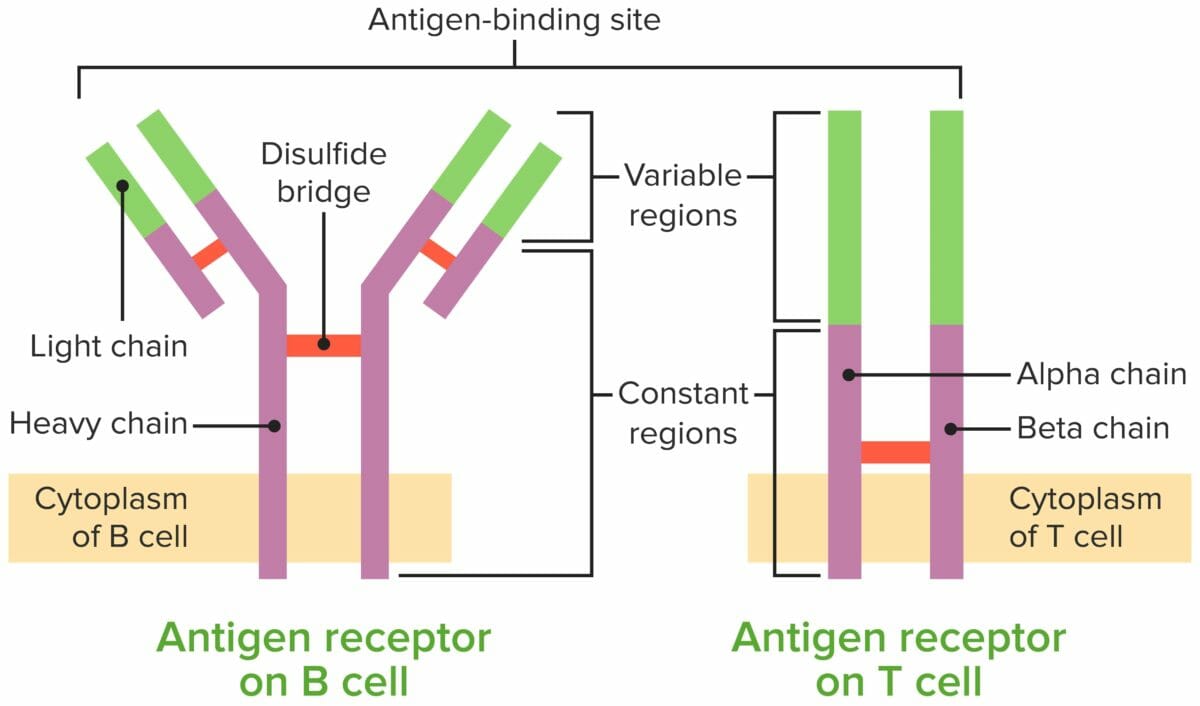
Comparação entre o recetor de células B (BCR) e o recetor de células T (TCR)
Imagem por Lecturio.Para atingir a funcionalidade, as células T passam por diversas etapas, desde que são libertadas da medula óssea como células progenitoras até ao seu desenvolvimento no timo. A tabela abaixo resume as principais etapas do processo.
| Estadio de maturação | Recetor de células T | Eventos associados |
|---|---|---|
| Célula progenitora | Nenhum |
|
| Células DN | Rearranjo da cadeia β (pré-TCR): a falha no rearranjo leva à apoptose |
|
| Células DP | Rearranjo da cadeia ɑ → as cadeias ɑ montam com cadeias β → complexo recetor ɑ–β TCR–CD3 completo (expresso na superfície) |
|
| Células T positivas únicas |
|
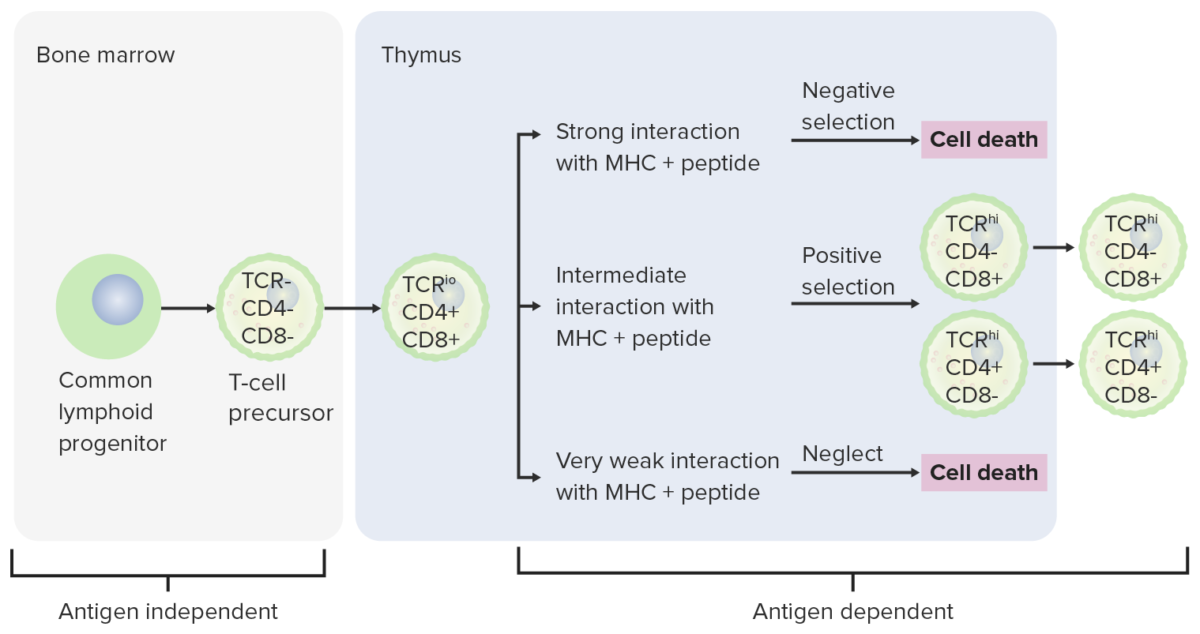
Estadios de diferenciação da célula T:
As células progenitoras vão da medula óssea para o timo para posterior maturação. As células DN (sem expressão de CD4/CD8 ou CD4–/CD8–) tornam-se células pró-T e, mais tarde, células pré-T, após o rearranjo do gene TCR. Durante os vários estadios, as células expressam CD4 ou CD8 e o TCR é adquirido através de rearranjos de genes (células DP). O timo apresenta moléculas de MHC para as células T em desenvolvimento. Algumas células sofrem seleção positiva (interação intermediária entre MHC e TCR) e produzem células funcionais. Algumas células sofrem seleção negativa (forte interação entre MHC e TCR), resultando em morte celular. A libertação de células T disfuncionais, que podem ativar a autoimunidade, é, então, evitada. As células T que não interagem sofrem apoptose. As células T maduras ou expressam CD4 (células T auxiliares) ou CD8 (células T citotóxicas), não ambos.
Recorde-se da “regra dos 8” :
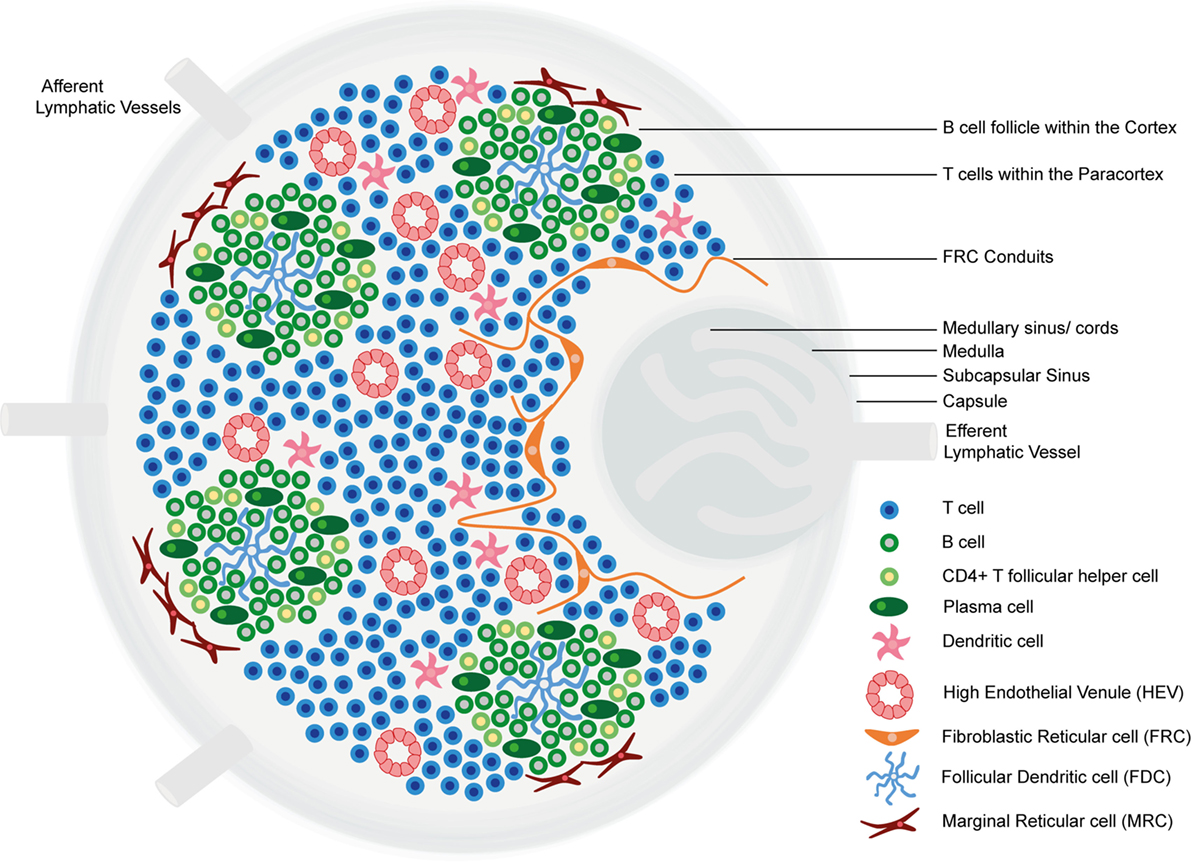
Estrutura e regiões funcionais de um nódulo linfático: formado por uma cápsula fibrosa rica em colagénio e um seio subcapsular (SCS, pela sigla em inglês) subjacente.
As células são secretadas no (1) córtex (constituído por células B, células T auxiliares foliculares e células dendríticas foliculares [FDCs, pela sigla em inglês], dispostos em folículos primários, nos quais as células B pesquisam os antigénios presentes na rede estromal da FDC); e (2) no paracórtex (que contém células T, células dendríticas [DCs, pela sigla em inglês] e células reticulares fibroblásticas [FRCs, pela sigla em inglês], que formam redes de células estromais e fibras reticulares).
A medula interna é composta por tecidos linfáticos (cordões medulares) separados por seios medulares constituídos por linfa.
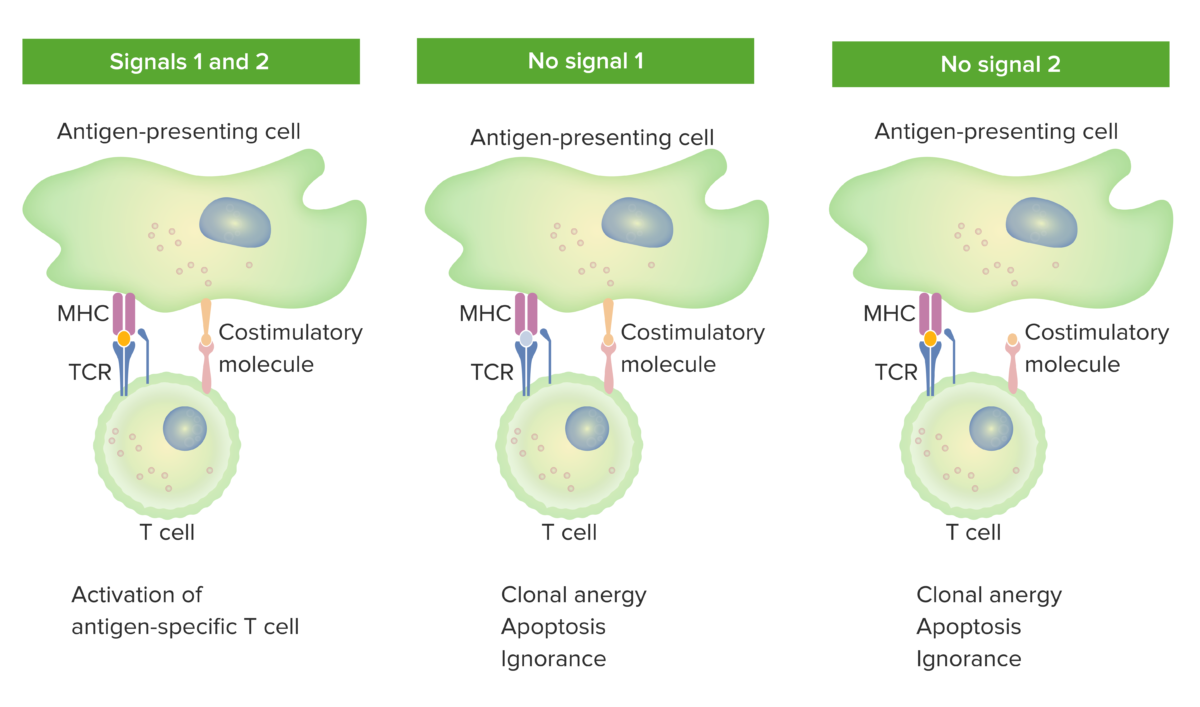
Sinais de dependência de células T na coestimulação:
Quando o sinal 1 (ligação do TCR ao antigénio apresentado pela molécula do MHC da célula apresentadora de antigénios) e o sinal 2 (interação da molécula coestimuladora entre a célula apresentadora de antigénios e a célula T) estão presentes, a célula T madura é totalmente ativada.
O ponto laranja na imagem da esquerda exemplifica a ligação adequada entre o antigénio e o TCR. No entanto, quando tanto o sinal 1 (a imagem do meio não apresenta a ligação do antigénio com o TCR) como o sinal 2 (a imagem da direita não mostra a coestimulação) estão ausentes, a célula T não é totalmente ativada.
O resultado esperado seria a anergia (estado de ausência de resposta), apoptose (morte celular) ou desconhecimento (a célula T não percebe ou não é afetada pelo antigénio).
TCR: recetor de células T
As células T auxiliares apresentam diferentes perfis de citocinas e papéis na resposta imune.
| Células T CD4+ | Diferenciação estimulada por | Funções | Citocinas produzidas |
|---|---|---|---|
| Th1 |
|
|
|
| Th2 |
|
|
|
| Th17 |
|
Promovem a inflamação neutrofílica |
|
| Tfh | IL-6 | Facilitam a ativação e maturação das células B |
|
| Treg |
|
|
|
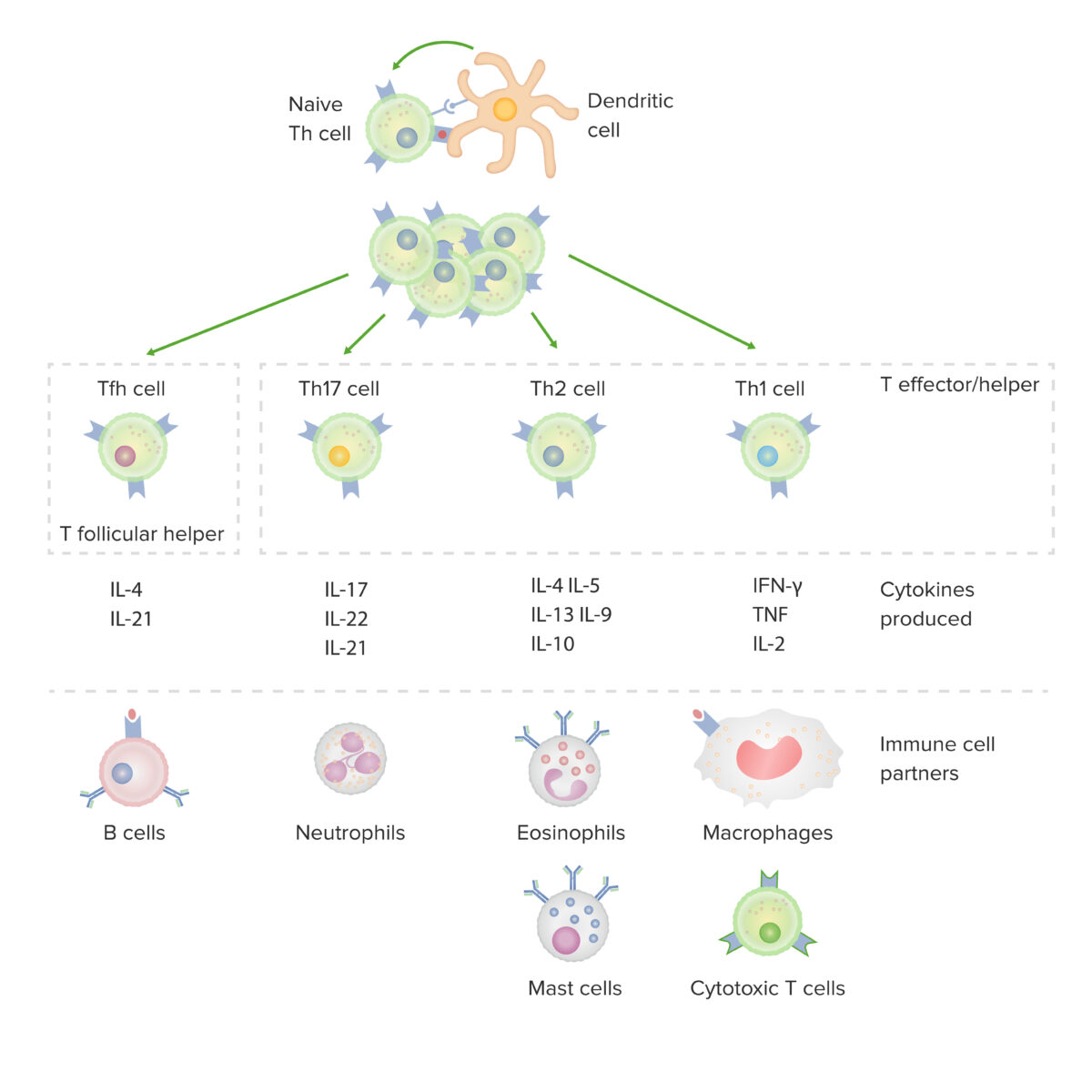
Subconjuntos de células T auxiliares CD4-positivas:
Após a ativação por uma célula dendrítica, na presença de citocinas específicas, uma célula T CD4 positiva “naive” divide-se e diferencia-se em subconjuntos efetores/auxiliares (Th1, Th2 ou Th17) ou auxiliares foliculares (Tfh). Cada tipo de célula produz citocinas que facilitam a ativação de outras células imunes.
IFN: interferão
TNF: fator de necrose tumoral
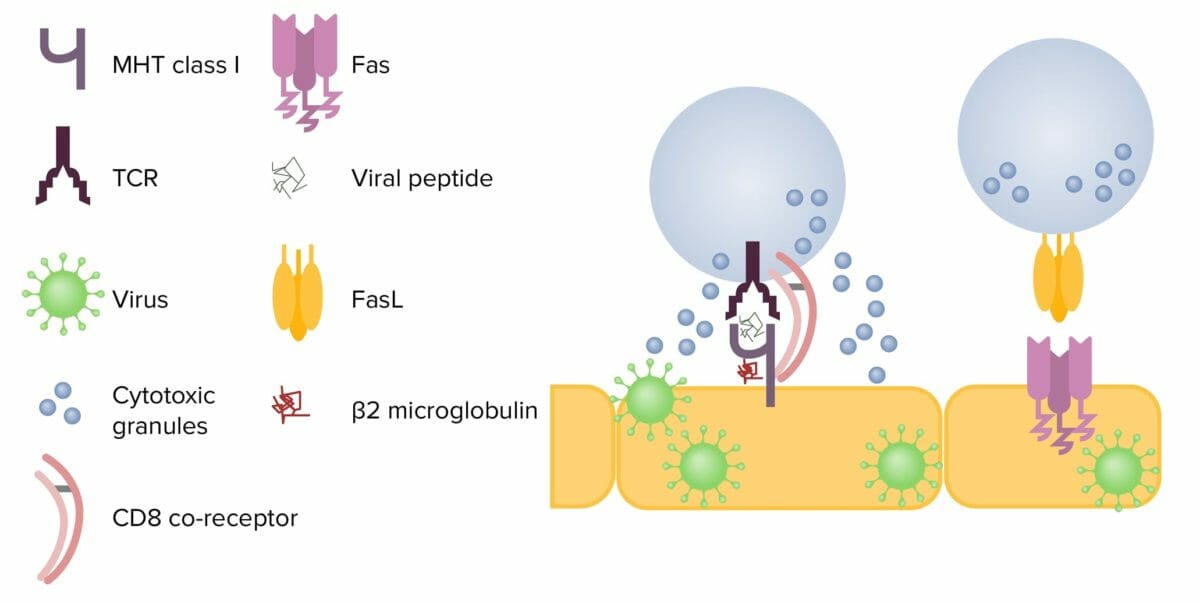
Mecanismos de citotoxicidade por células T CD8+:
À esquerda: Após contacto com uma célula infetada, a célula T liberta grânulos citotóxicos, perforina e granzimas. A perforina cria um poro na membrana da célula alvo, permitindo que as granzimas entrem na célula. Estas clivam proteínas no interior da mesma, levando à apoptose.
À direita: Quando o FasL interage com o Fas numa célula alvo, a cascata da caspase é ativada e termina em apoptose.
FasL, pela sigla em inglês: ligando Fas
TCR, pela sigla em inglês: recetor de células T
MHC, pela sigla em inglês: complexo principal de histocompatibilidade
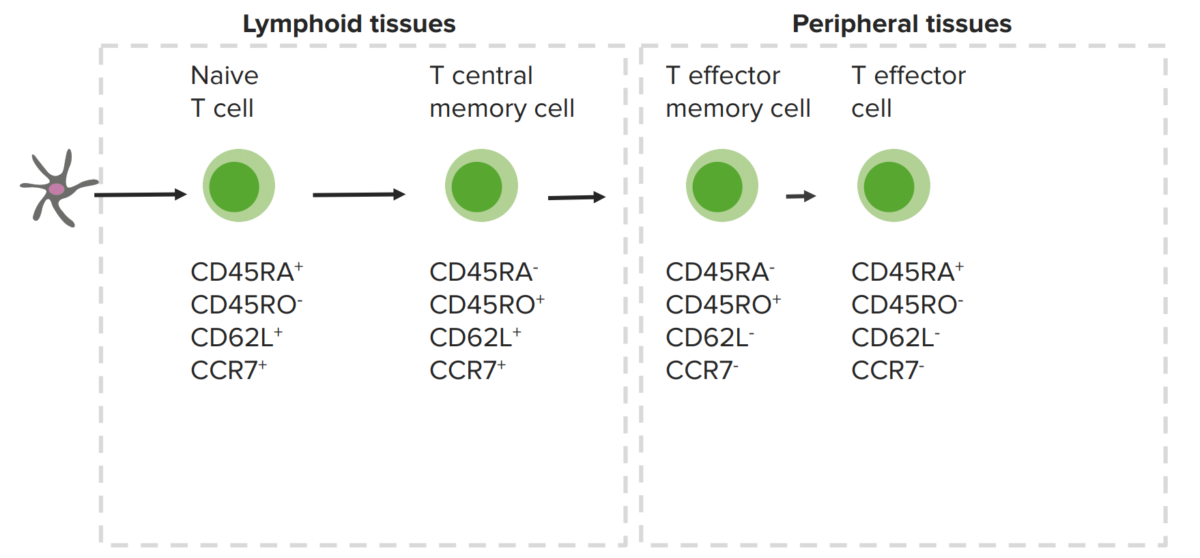
Células T de memória e marcadores celulares expressos:
As células T de memória central estão nos órgãos linfoides, enquanto as células T de memória periféricas estão nos tecidos periféricos.