Playlist
Show Playlist
Hide Playlist
Receptor Tyrosine Kinase Signaling
-
Slides HormonesSignalTransduction Biochemistry.pdf
-
Reference List Biochemistry.pdf
-
Download Lecture Overview
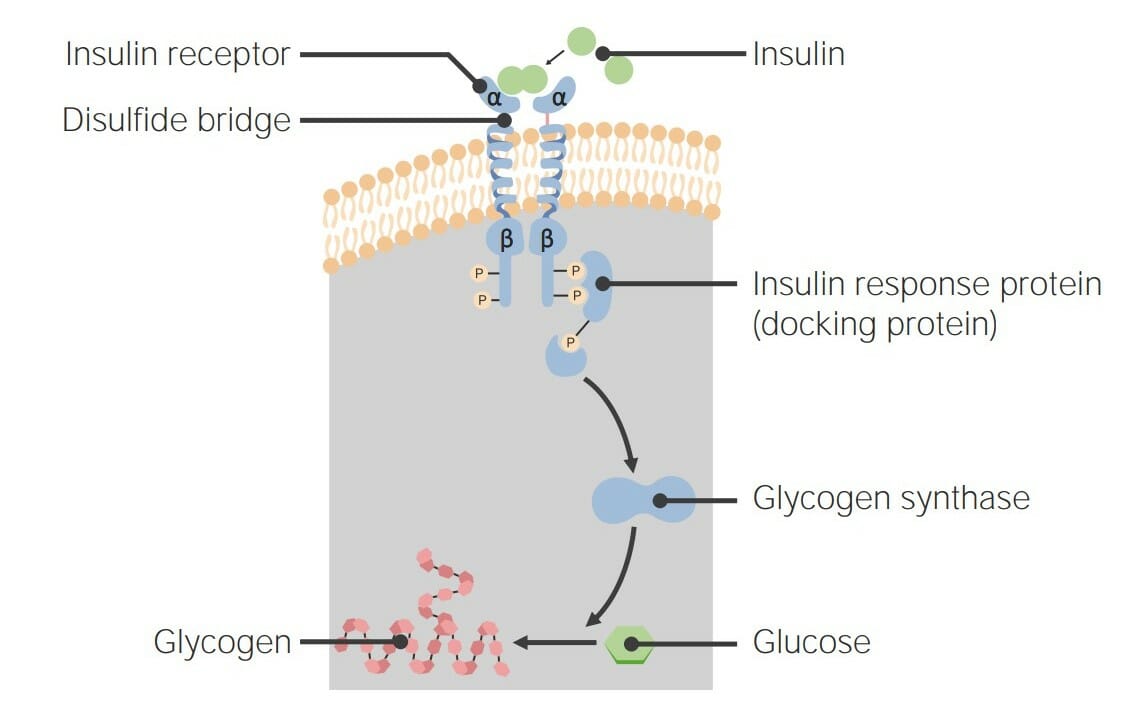
00:01 Als nächstes möchte ich über eine weitere sehr interessante Gruppe von Rezeptorproteinen sprechen. 00:06 Diese sind bekannt als Rezeptor-Tyrosinkinase Proteine und an sehr wichtigen Signalübertragungen beteiligt, die dazu beitragen, die Entscheidung der Zelle sich zu teilen oder nicht zu teilen, zu kontrollieren. 00:17 Rezeptor-Tyrosin-Kinasen oder RTKs sind ebenfalls membrangebundene Proteine. 00:24 Und sie sind auch Kinasen. 00:26 Das bedeutet, dass sie Phosphate auf andere Proteine übertragen. 00:30 Aber im Gegensatz zur Proteinkinase A, die Phosphate an Serine und Threonine bindet, setzen RTKs Phosphate an die Seitenketten von Tyrosinen der Zielproteine. 00:40 Und es stellt sich heraus, dass die Phosphorylierung von Tyrosinen eine ganz andere Art von Signal erzeugt als die Phosphorylierung von Serinen und Threoninen. 00:47 Hier sehen wir die Phosphorylierung von Tyrosin, die durch die Katalyse von RTK in diesem Prozess stattfindet und es ist einfach die Addition eines Phosphats an die Hydroxylgruppe von Tyrosin. 00:58 RTKs spielen, wie ich bereits sagte, eine sehr wichtige Rolle bei der Regulation, ob sich Zellen teilen oder nicht. 01:05 Nun funktionieren RTKs normalerweise als Ergebnis einer Dimerisierung. 01:10 Was bedeutet das? Nun, RTKs finden sich in Zellmembranen als einzelne Einheiten; ein RTK hier und ein RTK hier drüben. 01:18 Jede dieser einzelnen Einheiten ist in ihrer jetzigen Form inaktiv, aber die Bindung eines Hormons bewirkt, dass die beiden Untereinheiten oder die beiden Einheiten des Proteins zu einem Dimer zusammenkommen. 01:30 Dieses Dimer ist dann aktiv. 01:32 Die Aktivierung eines RTK erfolgt also durch die Bindung eines Hormons, das die Dimerisierung der einzelnen Untereinheiten bewirkt. 01:43 Wir sehen hier schematisch zwei RTKs, einzelne Untereinheiten, eingebettet in eine Lipiddoppelschicht. 01:49 Das ist die Lipiddoppelschicht. 01:50 Wir sehen, dass die Außenseite der Zelle oben ist und das Innere der Zelle ist unten. 01:54 Die RTK-Monomere haben eine Bindungsstelle für das Hormon. 01:58 Sie haben auch eine so genannte Transmembran-α-Helix und das ist einfach ein Teil des Proteins, der durch die Lipiddoppelschicht ragt. 02:06 Wie die sieben TM, die ich zuvor beschrieben habe, haben sie einen Teil, der außerhalb liegt, der die Nachricht auffängt und einen Teil im Inneren, der die Nachricht übermittelt. 02:16 Es ist die zytoplasmatische Domäne der Tyrosinproteinkinase, die bei Dimerisierung aktiviert wird. 02:22 Und wenn es in der monomeren Form ist, ist es inaktiv, wie Sie hier sehen. 02:27 So sieht der Aktivierungsprozess aus. 02:29 Wir sehen hier die Bindung eines Hormons. 02:32 Und die Bindung des Hormons bewirkt, dass die beiden Einheiten zusammenkommen. 02:37 Der untere Teil dieser Proteinuntereinheiten, wie ich hier gezeigt habe, sind eigentlich Tyrosinkinasen. 02:43 Und jetzt wurden sie aktiviert, indem man sie in die Nähe des Anderen gebracht hat. 02:48 Die Enden der einzelnen RTKs phosphorylieren sich gegenseitig. . 02:54 Das eine phosphoryliert das andere, was wiederum bewirkt, dass beide viel aktiver werden als zuvor. 03:01 Diese RTKs sind aktiv und sie können eines von zwei Dingen tun. 03:05 Sie können entweder andere Proteine in der Zelle mit Phosphaten versehen, oder die Tatsache, dass sie Phosphate tragen, Macht sie zu einem Ziel für die Bindung anderer Proteine an sie. 03:15 Wir werden sehen, wie das hier passiert. 03:18 Auf jeden Fall haben wir durch die Bindung des Hormons eine Aktivierung der Tyrosinkinase dieser RTKs erreicht. 03:27 Eines der Dinge, die passieren können, ist, wie ich schon sagte, dass andere Proteine an diese Phosphate, die sich dort befinden, binden. Die Bindung anderer Proteine wird durch einen speziellen Bindungsteil von Proteinen, genannt SH2-Domäne, vermittelt. SH2-Domänen erkennen Phosphotyrosine und binden sie an sich. Und das können wir hier tatsächlich bei der Bildung eines so genannten Signalkomplexes sehen. Der Signalkomplex hat mehrere Proteinuntereinheiten, die ich als einige Ovale und Dreiecke und einen Stern gezeichnet habe. 04:00 Und dieser Signalkomplex wird dabei helfen, diese Nachricht in die Zelle zu übermitteln. 04:08 Wenn wir uns ansehen, was hier passiert ist, sehen wir die Bindung des Hormons an den RTK in der Membran. 04:13 Der Rezeptor dimerisiert, es findet eine Autophosphorylierung statt. 04:17 Dies geschieht übrigens bei allen der RTKs, die ich beschreiben werde. 04:21 Als ein Signalkomplex der sich zusammensetzt. 04:23 Und nun wird die Nachricht in die Zelle weitergeleitet. 04:27 Hier ist also ein RTK, bekannt als der Insulinrezeptor. 04:31 Der Insulinrezeptor ist, wie der Name schon sagt, ein Protein in der Membran, das an Insulin bindet. 04:38 Und auf der Innenseite hat er die Tyrosin-Kinase. 04:41 Und diese Tyrosinkinase erlaubt ihm, Dinge zu phosphorylieren. 04:45 Der Insulinrezeptor ist eigentlich ein wenig ungewöhnlich, da er nicht als Monomer beginnt. 04:50 Er ist eine der wenigen RTKs, die tatsächlich als Dimer beginnen. 04:53 Die beiden Einheiten befinden sich bereits in unmittelbarer Nähe zueinander. 04:55 Sie sind aber erst dann aktiv, wenn sie sich an das Insulin binden. 04:59 Es ist die Bindung des Insulins, die dazu führt, dass sie aktiviert werden. 05:02 Aber die Aktivierung erfordert nicht, dass sie zusammenkommen, sie sind bereits zusammen. 05:07 Hier ist also der Prozess, der mit der Insulin-RTK abläuft - Autophosphorylierung. 05:13 Und jetzt sehen wir den Anfang des Signalkomplexes. 05:16 Der Signalkomplex beginnt mit der Bindung eines Proteins namens IRS-1. 05:20 Und IRS-1 hat mehrere Dinge, die es tun kann. 05:24 Es kann mit anderen Signalwegen interagieren, wie Sie an dem nach oben zeigenden Pfeil sehen, oder im Fall des Insulinweges ist das die Reaktion des Insulins. 05:32 Es aktiviert eine andere Kinase, bekannt als PI3. 05:38 PI3 katalysiert die Bildung eines Moleküls namens PIP3. 05:43 PIP3 ist ein zweiter Botenstoff. 05:45 Es ist ein kleines Molekül, das heißt, es ist kein Protein und es hilft dabei, diese Botschaft zu übermitteln. 05:50 PIP3 interagiert mit einem Protein namens PDK1, das eine andere Kinase ist, und aktiviert sie. 05:58 Schließlich bewirkt die Aktivierung der PDK1-Kinase, dass ein weiteres Protein an die Zelloberfläche gelangt. 06:04 Dieses andere Protein ist als GLUT4 bekannt. 06:08 Was ist GLUT4? GLUT4 steht für Glukose Transportprotein 4. 06:15 Was macht GLUT4? Nun, wenn es sich zur Zellmembran bewegt, verankert es sich in der Membran. 06:20 Und die Funktion von GLUT4 ist es, Glukose aus dem extrazellulären Teil der Zelle in die Zelle zu transportieren, damit die Glukose für die Zelle zur Verfügung steht. 06:30 Das ist wichtig, denn das ist was das Insulin letztendlich erreichen will. 06:34 Unser Körper produziert nach einer Mahlzeit Insulin und unser Blutzuckerspiegel steigt an. 06:40 Blutzucker ist tatsächlich gefährlich für den Körper. 06:44 Um den Blutzuckerspiegel zu senken, bindet Insulin an einen Rezeptor und stimuliert die Zellen die Glukose aufzunehmen, wodurch der Glukosespiegel in unserem Blutkreislauf reduziert wird. 06:54 Dieser Gesamtprozess, der viele Schritte hatte, hatte ein Ziel. 06:58 Und das eine Ziel war es, die Zellen dazu zu bringen, die Glukose aufzunehmen. 07:03 Nun, zusätzlich dazu, dass es bewirkt, dass Glukose in die Zelle gelangt, muss die Zelle mit der Glukose umgehen. 07:10 Nun, Glukose ist eigentlich das, was ich als Gift für eine Zelle bezeichne. 07:14 Das bedeutet, dass zu viel davon wirklich ein Problem verursacht. 07:17 Die Zelle möchte also nicht zu viel freie Glukose in sich herumliegen haben. 07:23 Wie geht sie mit dieser zusätzlichen Glukose um? Erinnern Sie sich an den Weg, den ich Ihnen für den Glykogenabbau und die Glykogensynthese gezeigt habe, dort habe ich gezeigt, dass Phosphoproteinphosphatase an diesem letzten Schritt beteiligt ist, der den Abbau von Glykogen inaktiviert und die Synthese von Glykogen aktiviert. 07:42 Diese Phosphoproteinphosphatase schaltet den Glykogenabbau aus und die Glykogensynthese ein. 07:50 Was braucht es für die Glykogensynthese? Glukose. 07:53 Die Glukose, die in die Zelle kommt, wird also in Glykogen umgebaut und Glykogen ist kein Gift für die Zelle. 07:59 Ein ziemlich cooler Prozess. 08:03 Nun, die Signale des Insulins stehen in einer Wechselwirkung mit den Signalen des Adrenalins. 08:08 Und das möchte ich Ihnen auf dieser Folie zeigen. 08:10 Der β-adrenerge Rezeptorweg, welcher der Weg war, der den Abbau von Glykogen aktivierte, funktioniert auf die hier gezeigte Weise. 08:18 Und ich werde nicht alle einzelnen Schritte durchgehen. 08:20 Das Ergebnis ist, dass Glykogen abgebaut wird und der Blutzuckerspiegel ansteigt. 08:26 Das ist gut, wenn jemand Sie verfolgt, denn dann wollen Sie die Energie haben, um weglaufen zu können. 08:30 Nachdem Sie jedoch eine Mahlzeit gegessen hast, wollen Sie sich mit der Glukose beschäftigen. 08:33 Daran ist der Insulinrezeptorweg beteiligt, der mehrere Aufgaben erfüllt. 08:38 Das eine ist, dass es die GLUT zur Membran bewegt, sodass die Glukose nun durch die Membran und in die Zelle wandern kann. 08:45 Und die Phosphoproteinphosphatase wird aktiviert, sodass der Abbau aufhören und die Synthese des Glykogen beginnen kann. Infolge der Insulinwirkung wird Glykogen gebildet und der Blutzuckerspiegel sinkt. Diese Prozesse laufen bei der gegenseitigen Regulierung, die ich zuvor beschrieben habe, genau entgegengesetzt ab.
About the Lecture
The lecture Receptor Tyrosine Kinase Signaling by Kevin Ahern, PhD is from the course Hormones and Signal Transduction. It contains the following chapters:
- Receptor Tyrosine Kinase Signaling
- Means of Activation
- Insulin Receptor
Included Quiz Questions
Which statement regarding receptor tyrosine kinases (RTKs) is true?
- They autophosphorylate on binding their hormone.
- They are active primarily as monomers.
- They remove phosphate from proteins.
- They do not regulate cell proliferation.
Which statement regarding phosphorylation of tyrosines on receptor tyrosine kinases (RTKs) is true?
- It requires dimerization.
- It can occur on the outside or inside of the cell.
- It turns off the signaling system.
- SH2 domains have no role to play.
Which statements regarding the signaling complex of receptor tyrosine kinases (RTKs) are true? Select all that apply.
- It has proteins that bind to phosphotyrosines.
- It involves the activation of intranuclear receptors.
- It transmits signals from the inside of the cell to the outside of the cell.
- It has proteins with SH2 domains.
- It communicates the message to the rest of the cell.
Which statement regarding insulin signaling is true?
- It activates phosphoprotein phosphatase.
- It activates the cyclic AMP pathway.
- It causes blood glucose levels to rise.
- Insulin signaling occurs in the same manner as epinephrine signaling.
Customer reviews
4,5 of 5 stars
| 5 Stars |
|
1 |
| 4 Stars |
|
1 |
| 3 Stars |
|
0 |
| 2 Stars |
|
0 |
| 1 Star |
|
0 |
I have taken biochem as an undergrad, grad. and post grad and I've never had anyone explain things as clearly. Dr. Ahern is one of the best teachers I've ever encountered. Thank you!
1 customer review without text
1 user review without text