Los riñones regulan la homeostasis del agua y los solutos mediante los procesos de filtración, reabsorción, secreción y excreción. Tras la filtración de la sangre a través de los glomérulos, el sistema tubular toma el relevo y se encarga de ajustar la composición de la orina a través del resto de la nefrona. La reabsorción, secreción y excreción se producen a través de mecanismos de transporte activos y pasivos y responden dinámicamente a las necesidades actuales del organismo para mantener la homeostasis de la composición del plasma y el volumen sanguíneo. Los segmentos primarios del sistema tubular incluyen el túbulo proximal, el asa de Henle, el túbulo contorneado distal y los conductos colectores. Cada segmento tiene transportadores y funciones únicas.
Última actualización: Mar 5, 2023
El sistema tubular se compone de:
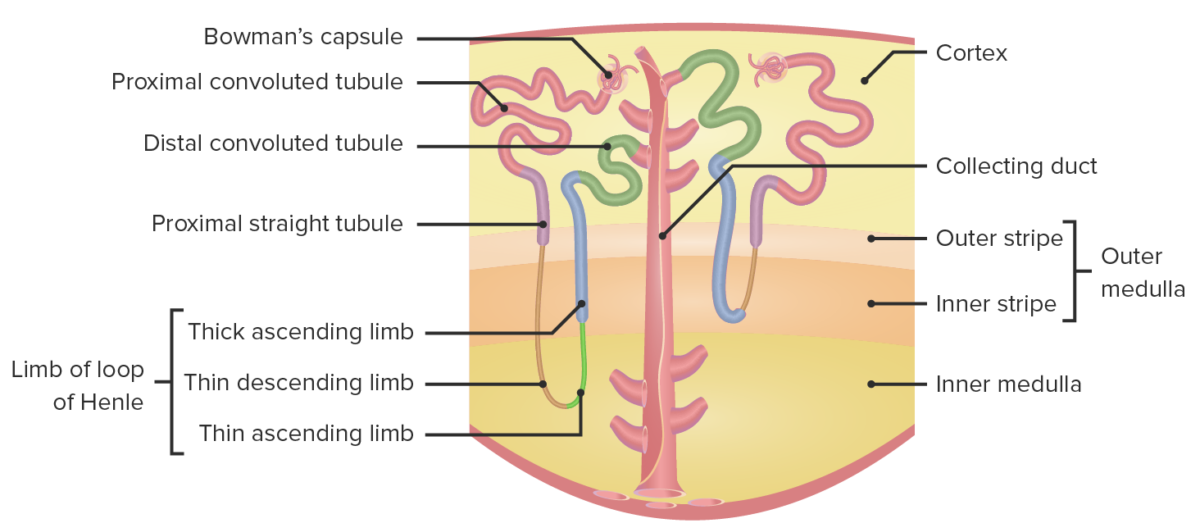
Segmentos de la nefrona
Imagen por Lecturio. Licencia: CC BY-NC-SA 4.0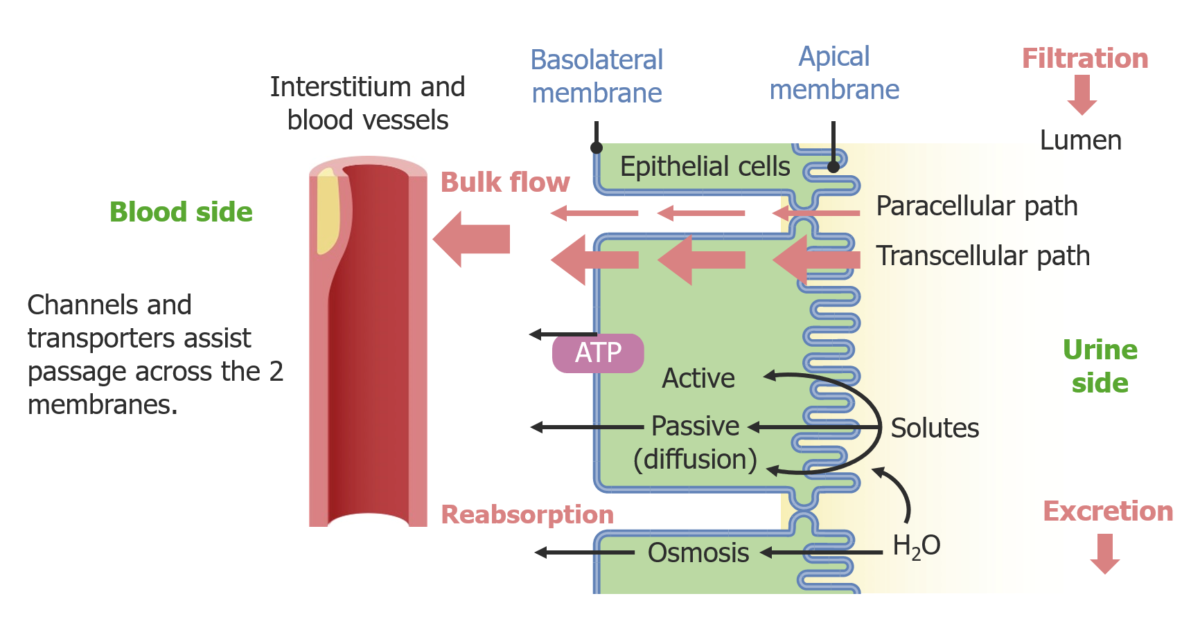
Vías de transporte epitelial de solutos desde el lumen tubular
Imagen por Lecturio. Licencia: CC BY-NC-SA 4.0
Establecimiento del gradiente de concentración de Na+ y del gradiente de voltaje por la Na+/K+-ATPasa
Imagen por Lecturio. Licencia: CC BY-NC-SA 4.0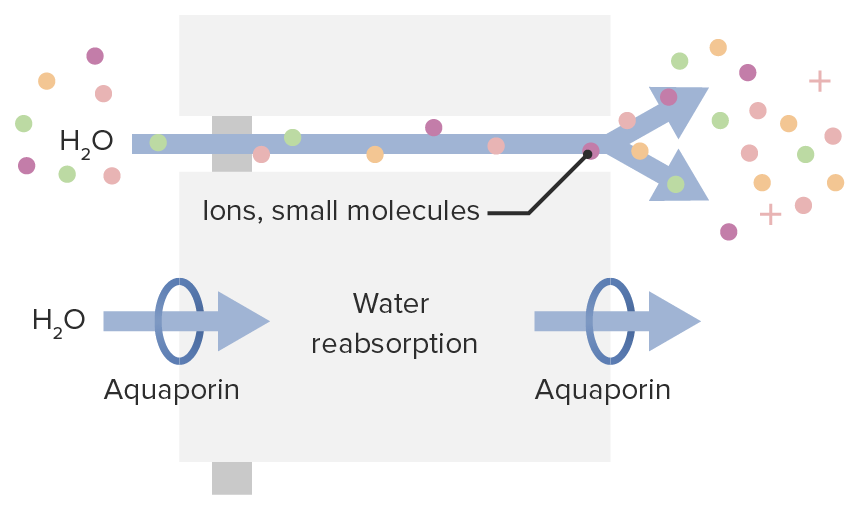
Mecanismos de movimiento del agua a través de la célula:
La vía superior muestra el movimiento paracelular del agua a través de las uniones estrechas con arrastre por solvente.
La vía inferior muestra el movimiento transcelular del agua a través de los canales de acuaporina.
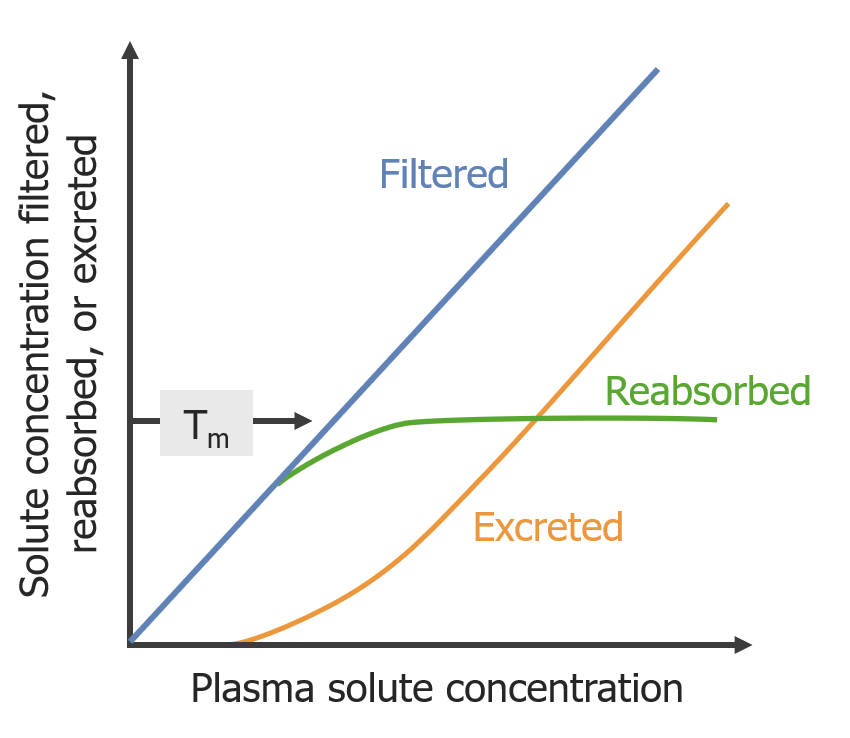
Efecto del transporte máximo en la excreción
tm= transporte máximo
La reabsorción capilar peritubular difiere de la reabsorción capilar regular para maximizar la reabsorción de sustancias de vuelta al torrente sanguíneo.
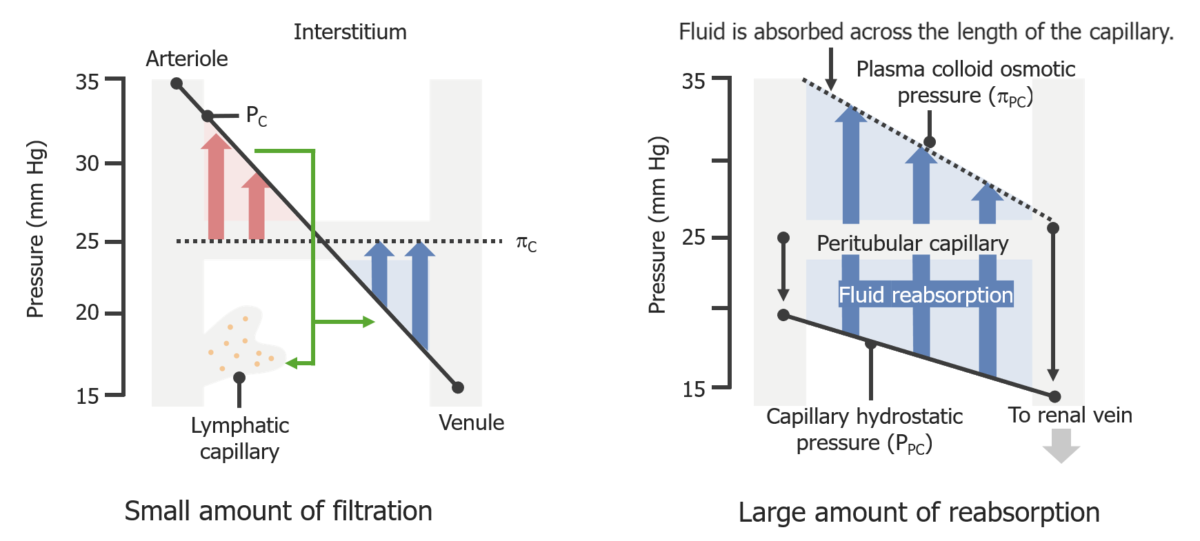
Fuerzas de Starling de un capilar regular (izquierda) y de un capilar peritubular (derecha).
En ambas imágenes, las líneas de puntos representan la presión oncótica, mientras que la línea sólida representa la presión hidrostática.
La filtración glomerular es un proceso muy inespecífico, que da lugar a la filtración de grandes cantidades de sustancias importantes que el organismo necesita retener (e.g., Na+, bicarbonato (HCO3–)). La función principal del túbulo proximal es reabsorber la mayor cantidad posible de estas sustancias. Posteriormente, los otros segmentos de la nefrona afinan la composición de la orina.
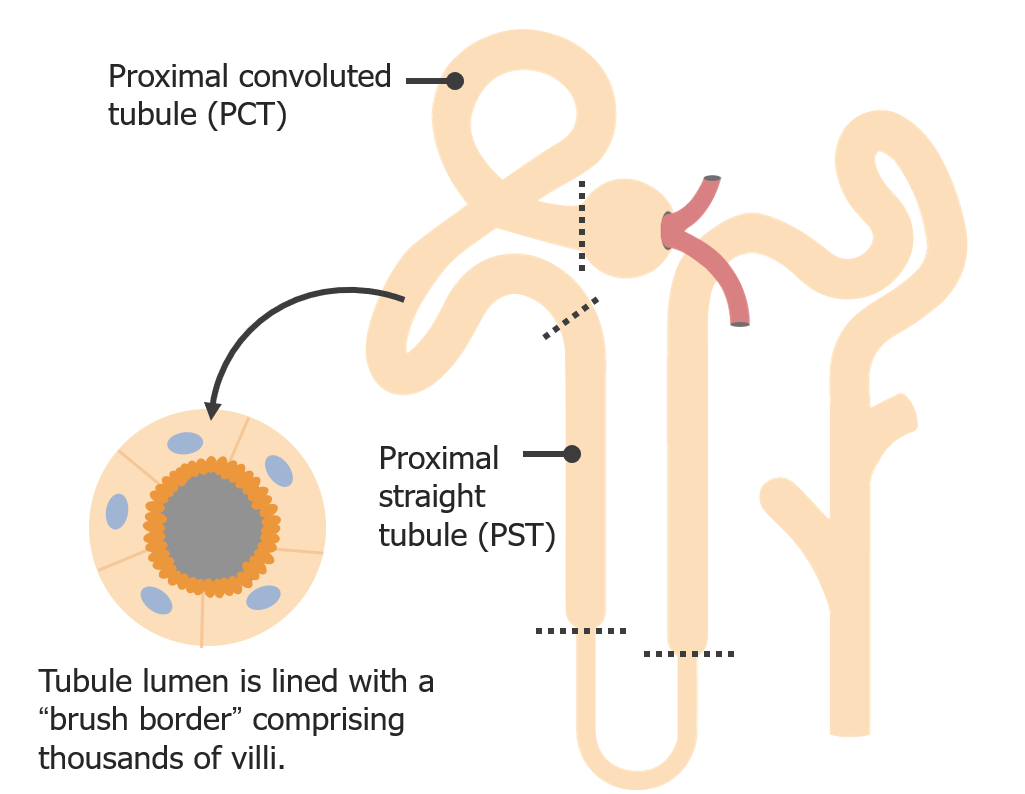
Anatomía del túbulo proximal
Imagen por Lecturio. Licencia: CC BY-NC-SA 4.0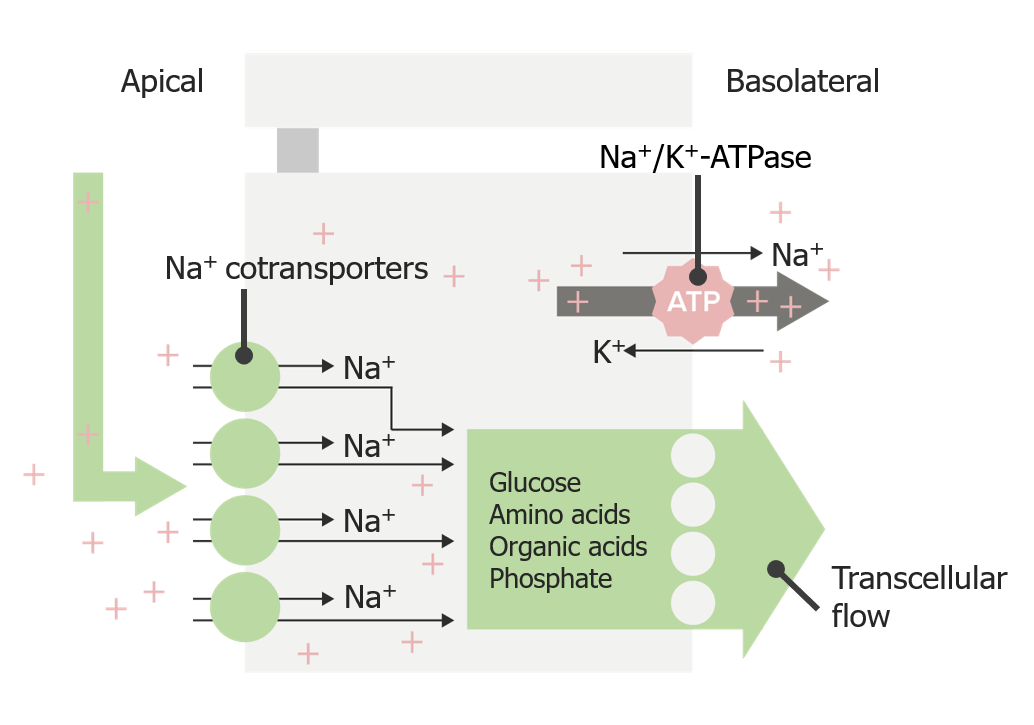
Reabsorción de sodio mediante cotransporte transcelular en el túbulo proximal
Imagen por Lecturio. Licencia: CC BY-NC-SA 4.0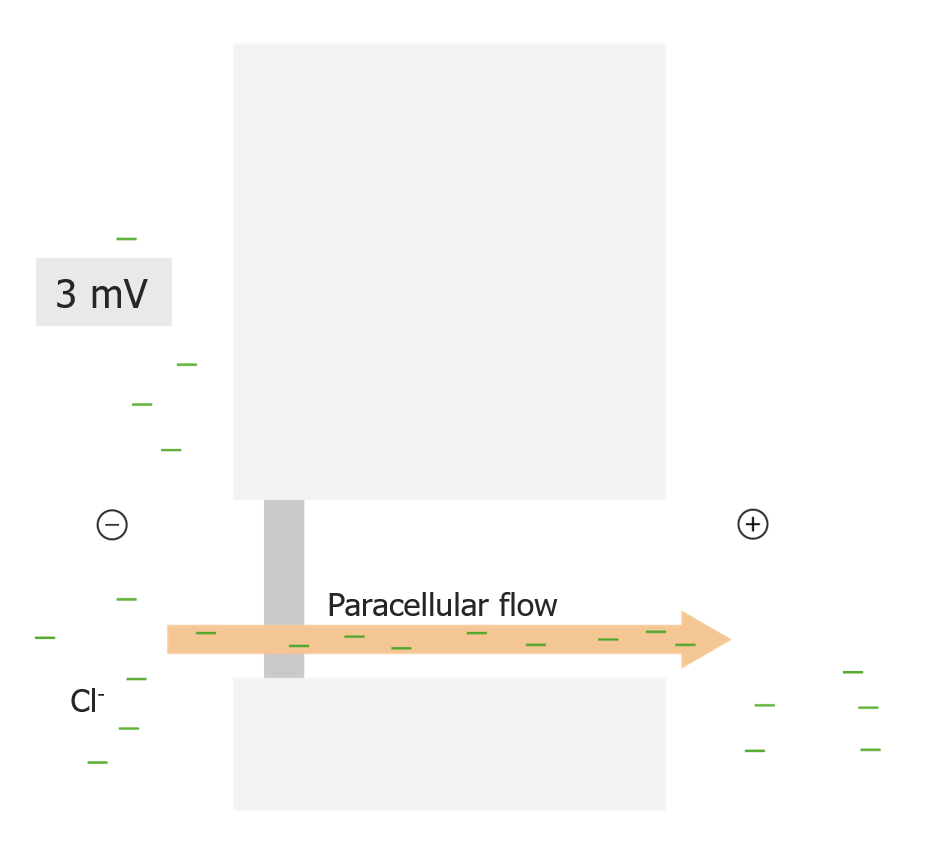
Transporte de cloruro en el túbulo proximal
Imagen por Lecturio. Licencia: CC BY-NC-SA 4.0
Transporte de potasio en el túbulo proximal:
En el túbulo proximal temprano, la reabsorción de potasio se produce principalmente a través del arrastre por solventes con la reabsorción de agua. En el túbulo proximal tardío, el gradiente de voltaje se invierte (debido a la reabsorción ascendente de Cl–) y el potasio se reabsorbe por difusión paracelular a través de las uniones estrechas siguiendo el gradiente eléctrico.
La reabsorción de HCO3– requiere un mecanismo más complejo:
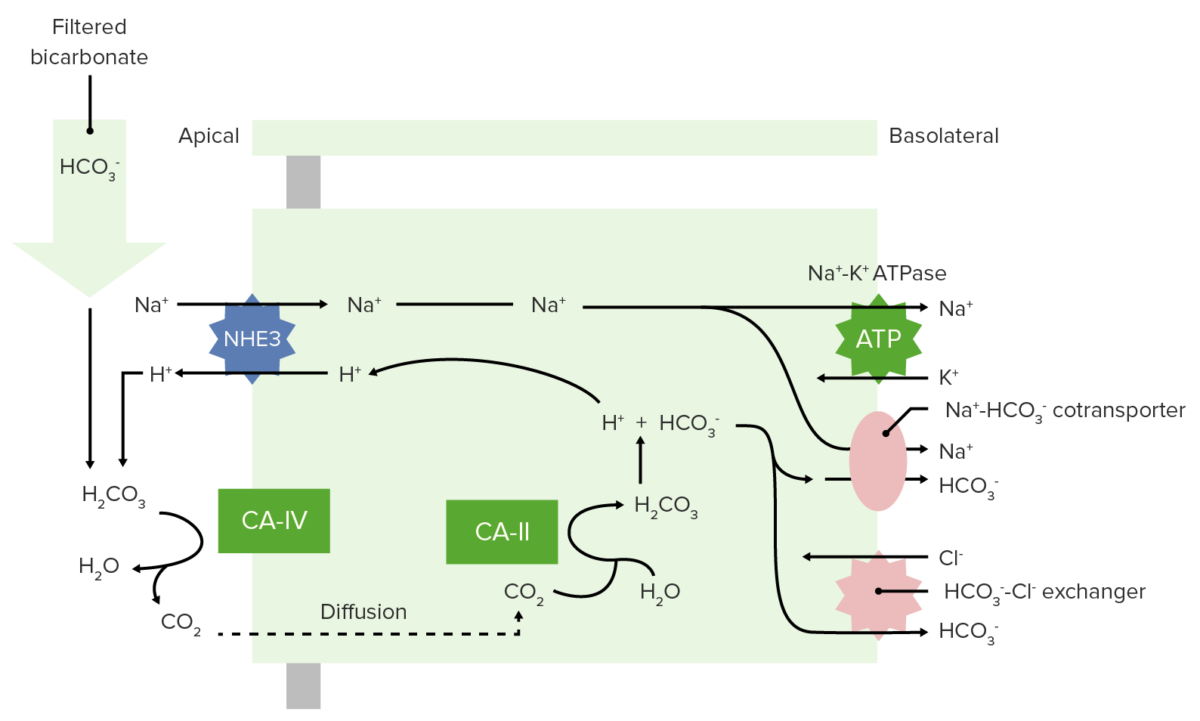
Reabsorción de bicarbonato en el túbulo proximal
CA-IV: anhidrasa carbónica IV
CA-II: anhidrasa carbónica II
Intercambiador de iones sodio- 3 hidrógenos (NHE3)
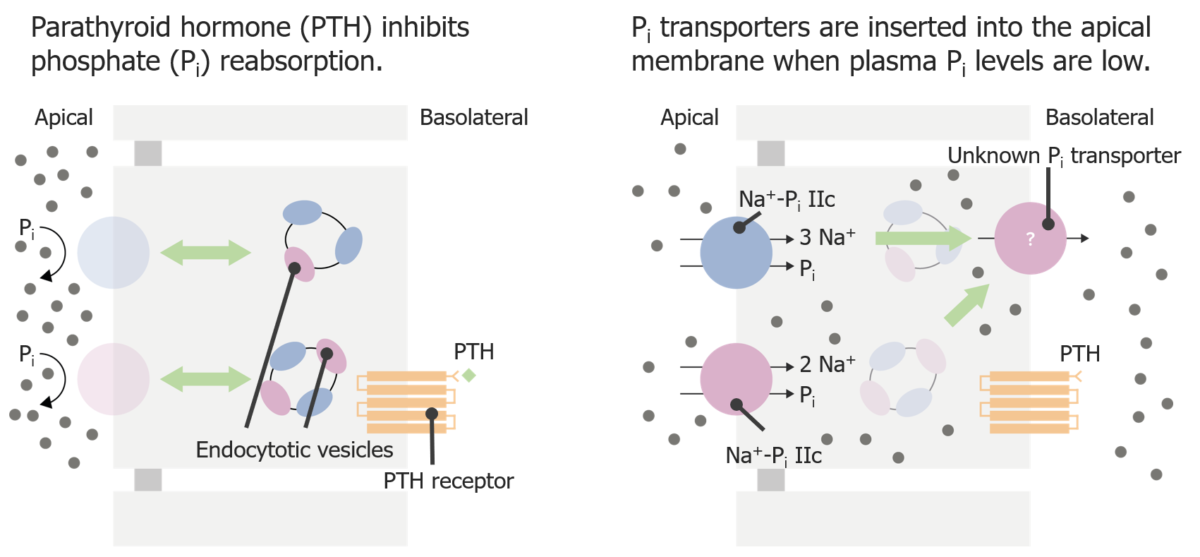
Reabsorción de fosfato en el túbulo proximal
Imagen por Lecturio. Licencia: CC BY-NC-SA 4.0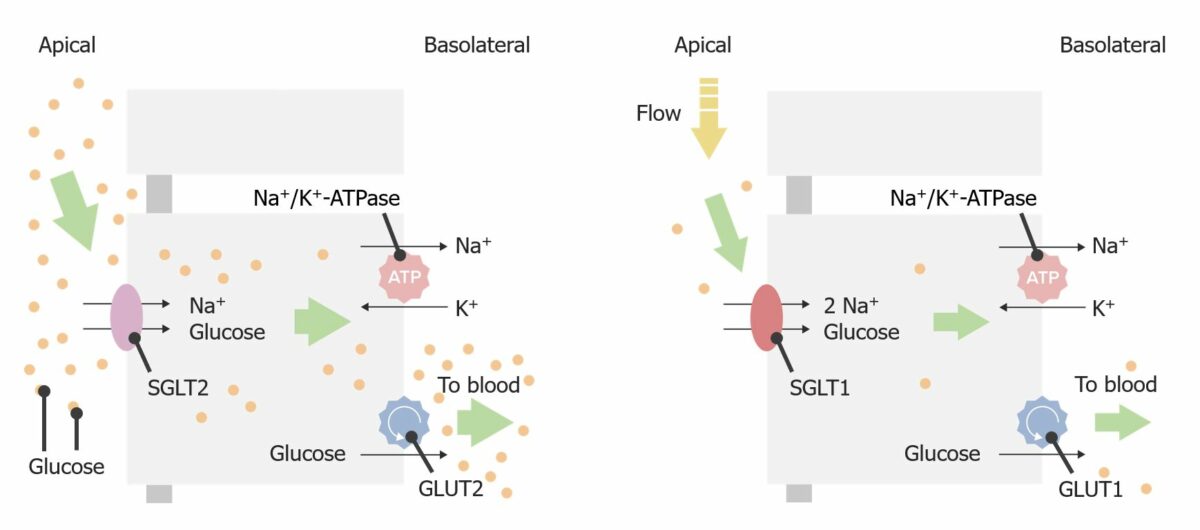
Transporte de glucosa en el túbulo proximal
GLUT: transportador de glucosa
SGLT: transportador ligado a la sodio-glucosa
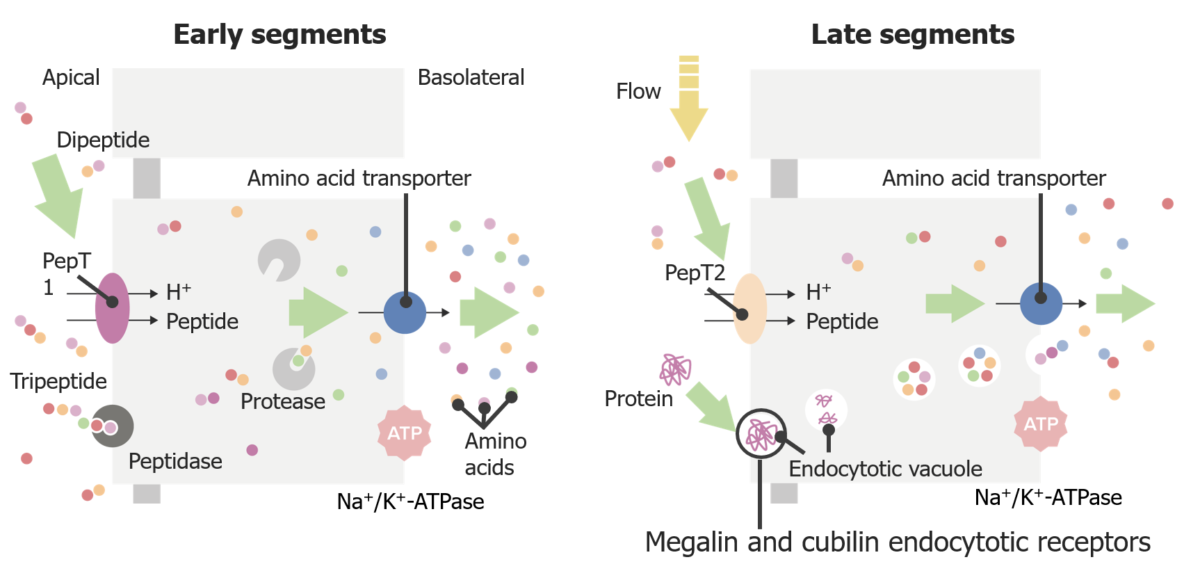
Transporte de péptidos en el túbulo proximal
Imagen por Lecturio. Licencia: CC BY-NC-SA 4.0La secreción se produce principalmente en el túbulo recto proximal (i.e., túbulo proximal tardío) y permite la eliminación de sustancias endógenas y exógenas, como toxinas y medicamentos.

Secreción de aniones orgánicos en el túbulo proximal tardío
MRP2: transportador multirresistente a medicamentos
NaDC: Transportador de dicarboxilato dependiente de Na+
OA–: anión orgánico
OAT: transportador de aniones orgánicos α-KG: α-cetoglutarato
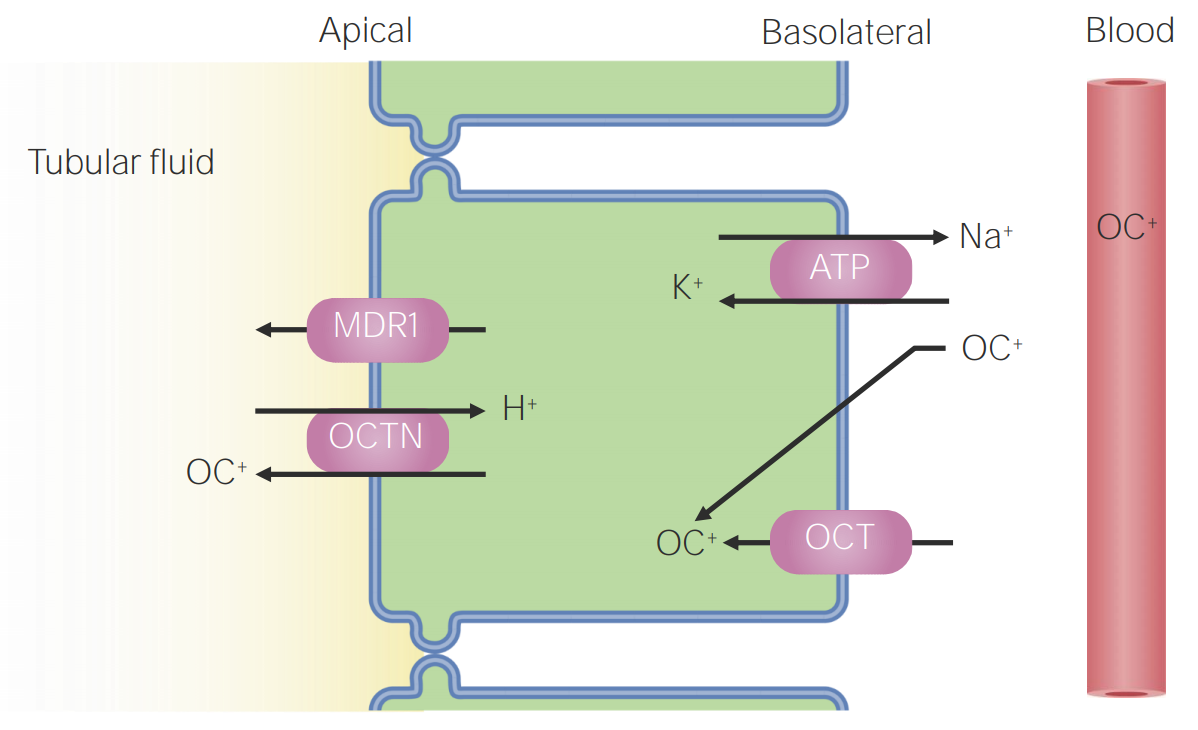
Secreción de cationes orgánicos (OC+) en el túbulo proximal
MDR1: transportador multirresistente a medicamentos
OCT: transportador de cationes orgánicos
OCTN: transportador de cationes orgánicos nuevo
| Sustancias endógenas | Medicamentos | |
|---|---|---|
| Aniones orgánicos |
|
|
| Cationes orgánicos |
|
|
El asa de Henle es un segmento complejo de la nefrona con 2 objetivos principales: mantener el gradiente corticomedular y reabsorber cantidades moderadas de Na+ y agua. Estos 2 procesos están vinculados a través del sistema multiplicador de contracorriente en las porciones delgadas, y la absorción adicional de Na+ se produce a través del transporte activo en la porción gruesa ascendente.
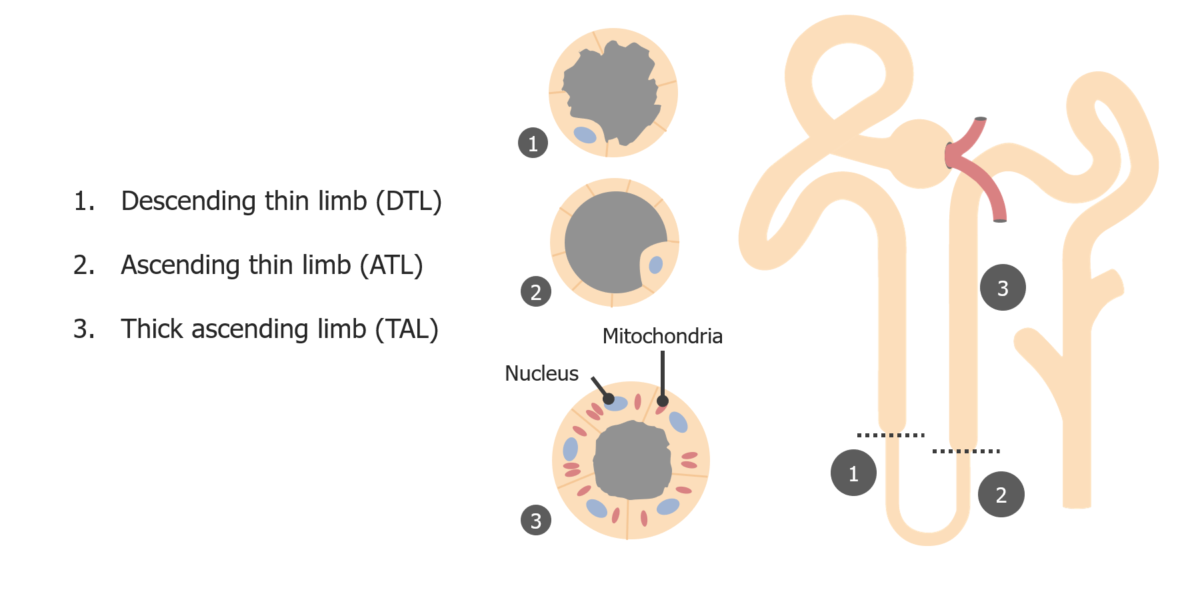
Secciones anatómicas del asa de Henle
Imagen por Lecturio. Licencia: CC BY-NC-SA 4.0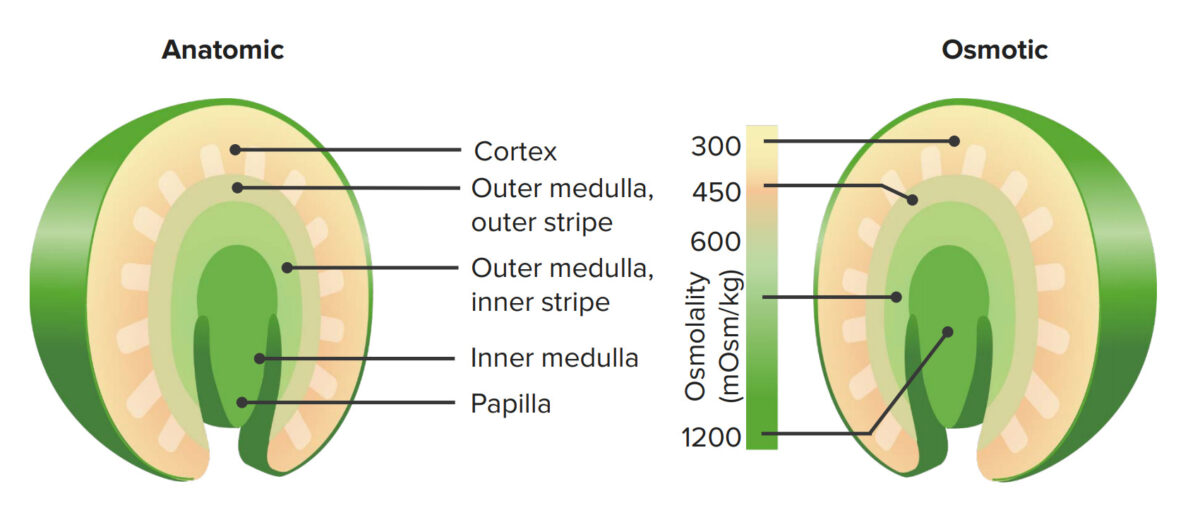
Gradiente corticomedular
Imagen por Lecturio. Licencia: CC BY-NC-SA 4.0La teoría del multiplicador de contracorriente explica cómo el movimiento de fluidos y solutos crea un gradiente corticomedular significativo. Este proceso se produce principalmente en las porciones delgadas del asa de Henle y a través del reciclaje de la urea.
Dentro de las porciones delgadas del asa de Henle:
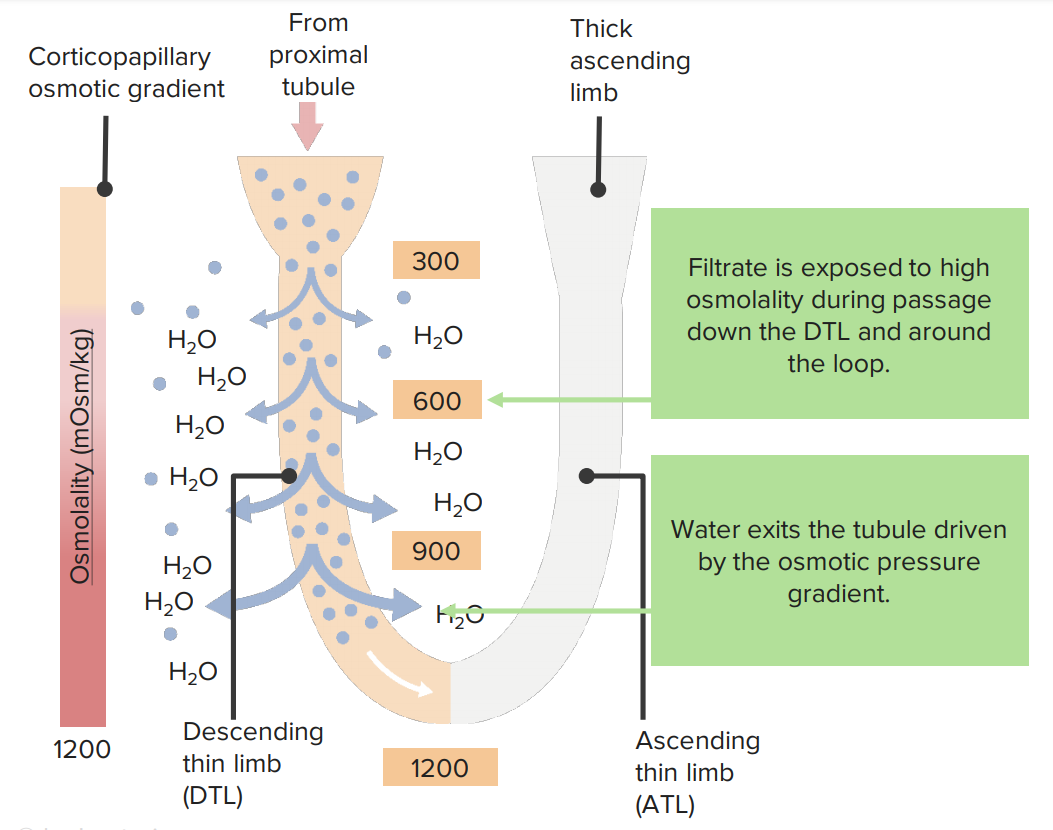
Efecto del gradiente corticomedular en el transporte de agua y sodio en la porción delgada descendente (DTL, por sus siglas en inglés)
Imagen por Lecturio. Licencia: CC BY-NC-SA 4.0
Efecto del gradiente corticomedular en el transporte de agua y sodio en la porción delgada ascendente (ATL, por sus siglas en inglés)
Imagen por Lecturio. Licencia: CC BY-NC-SA 4.0Reciclaje de urea:
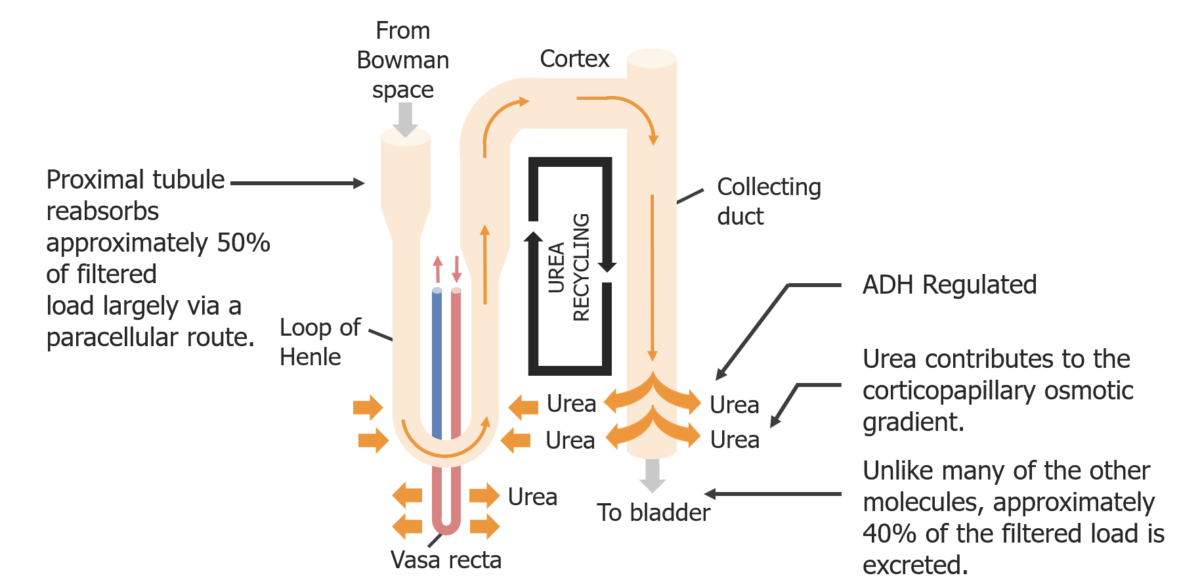
El reciclaje de la urea contribuye al gradiente corticomedular
Imagen por Lecturio. Licencia: CC BY-NC-SA 4.0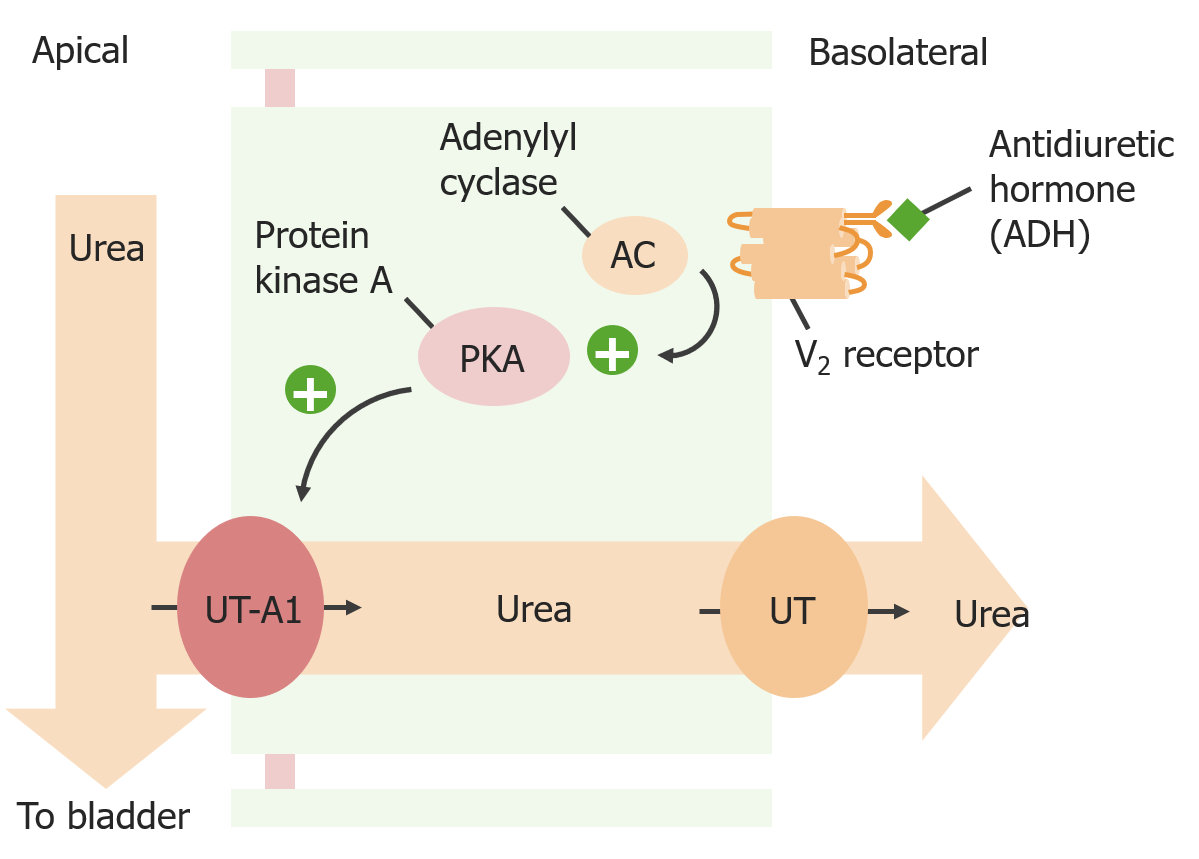
Reabsorción de urea mediada por la hormona antidiurética en el conducto colector
Imagen por Lecturio. Licencia: CC BY-NC-SA 4.0El cotransportador de Na-K-2Cl (NKCC2) es la proteína de transporte clave en la porción gruesa ascendente.
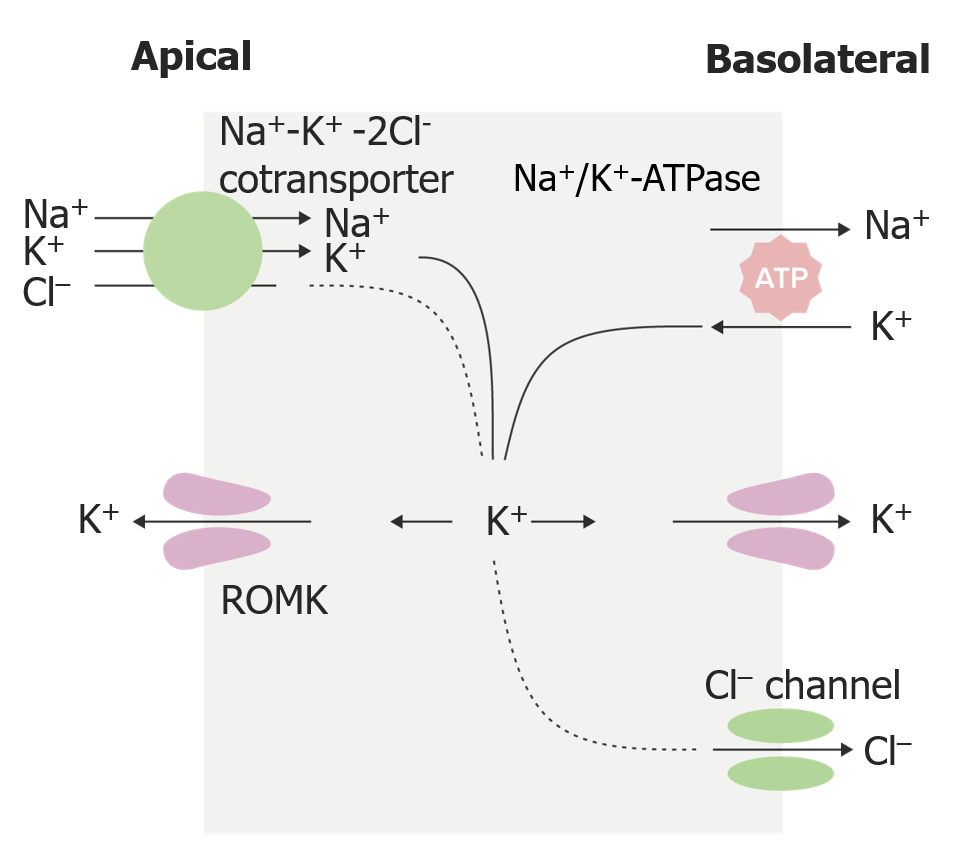
Movimiento de iones en la porción gruesa ascendente
Imagen por Lecturio. Licencia: CC BY-NC-SA 4.0El túbulo contorneado distal es otro “segmento diluyente” de la nefrona, donde el cotransportador de NaCl sensible a la tiazida ayuda a generar líquido tubular hipotónico debido a que el túbulo contorneado distal no es permeable al agua. El transporte de K+, Mg2+ y Ca2+ también se produce en este segmento.
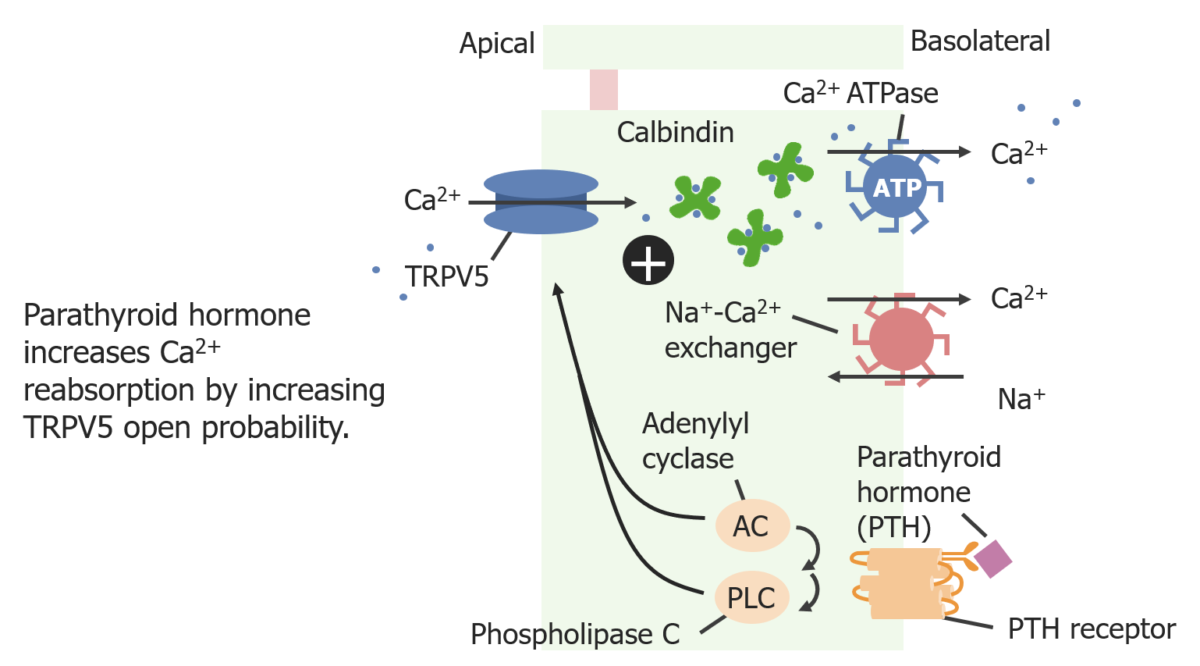
Reabsorción de calcio en el túbulo distal
Imagen por Lecturio. Licencia: CC BY-NC-SA 4.0Se produce a través de 2 mecanismos:
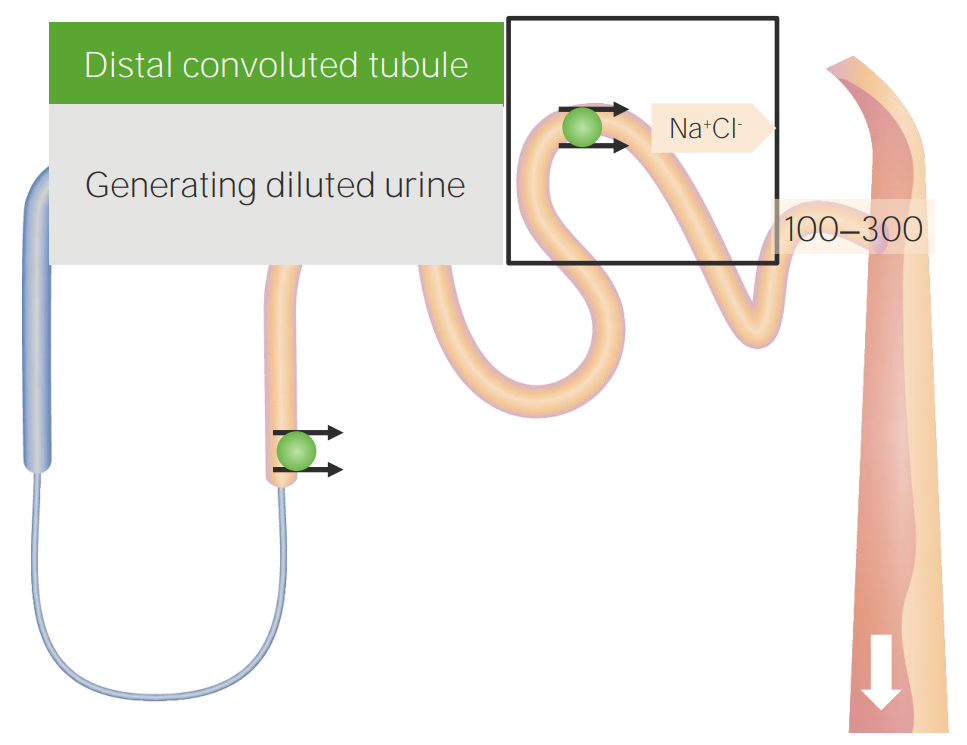
Reabsorción del túbulo contorneado distal:
El sodio y el cloruro se reabsorben en el túbulo contorneado distal, pero este no es permeable al agua, lo que permite la dilución de la orina.
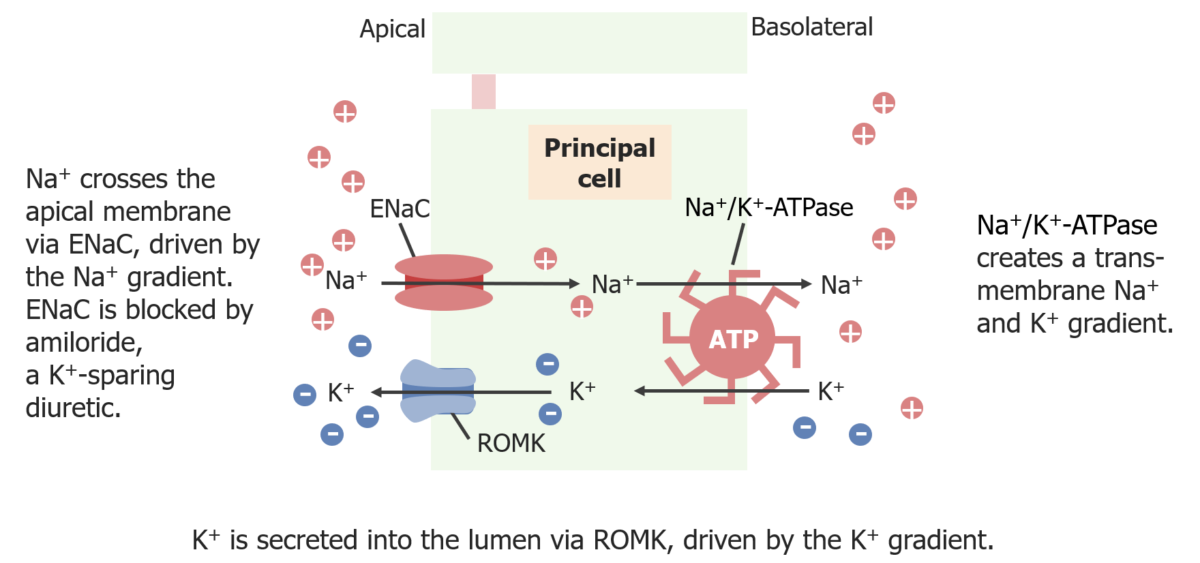
Reabsorción de sodio y potasio en el túbulo distal
Imagen por Lecturio. Licencia: CC BY-NC-SA 4.0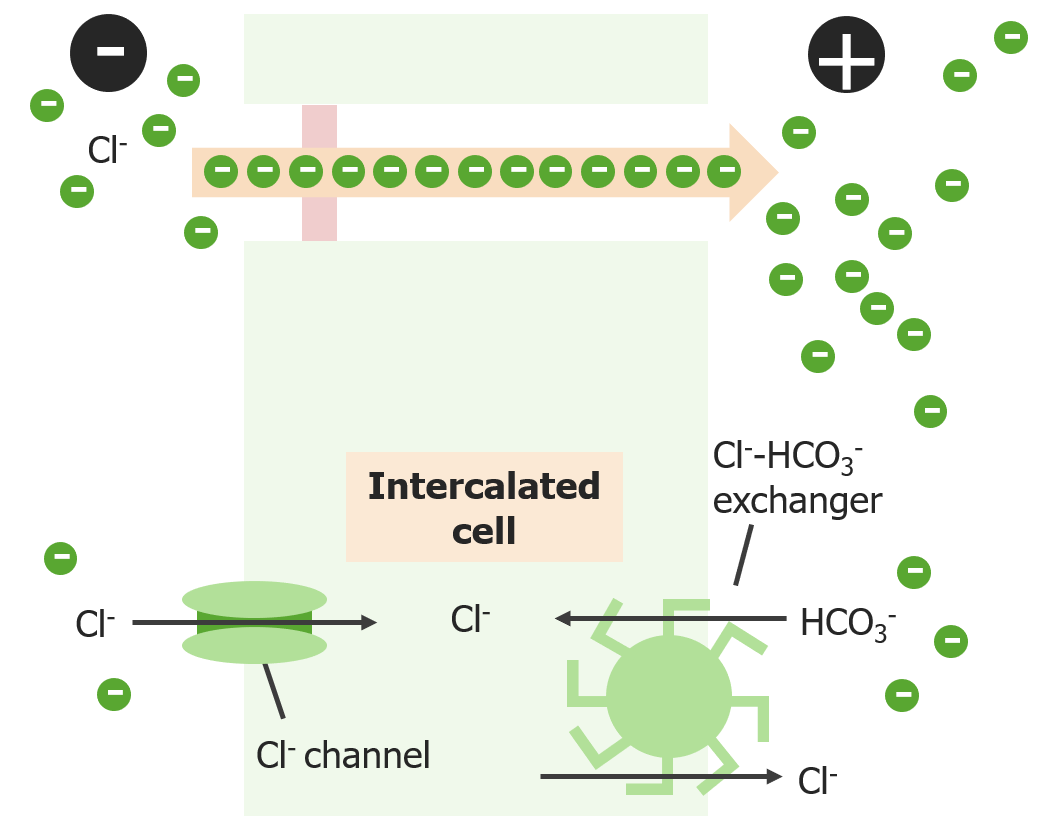
Reabsorción de cloruro en el túbulo contorneado distal tardío
Imagen por Lecturio. Licencia: CC BY-NC-SA 4.0Los conductos colectores son los puntos en los que confluyen múltiples nefronas durante las etapas finales de la formación de la orina. Las células intercaladas y las células principales actúan para ajustar la composición final y la concentración de la orina, antes de su eliminación.
Las células intercaladas se dividen a su vez en subtipos α y β, teniendo cada uno de ellos una composición ligeramente diferente de transportadores y otras proteínas.
Proteínas apicales:
Proteínas basolaterales:
Las células principales son responsables del ajuste de Na+ y K+ en la orina, que suele ser una respuesta a la hormona aldosterona. Las células principales son también el lugar donde se encuentra el canal de acuaporina apical AQP2, que es un componente clave en el ajuste de la concentración de orina.
Proteínas apicales:
Basolateral: Na+/K+-ATPasa
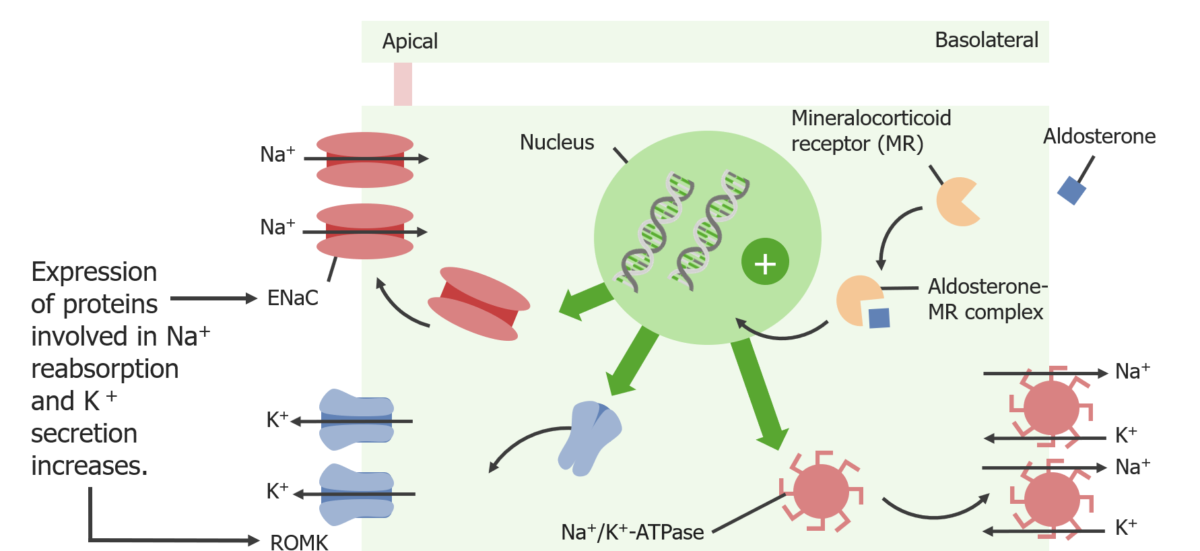
Acciones de la aldosterona en la célula principal
Imagen por Lecturio. Licencia: CC BY-NC-SA 4.0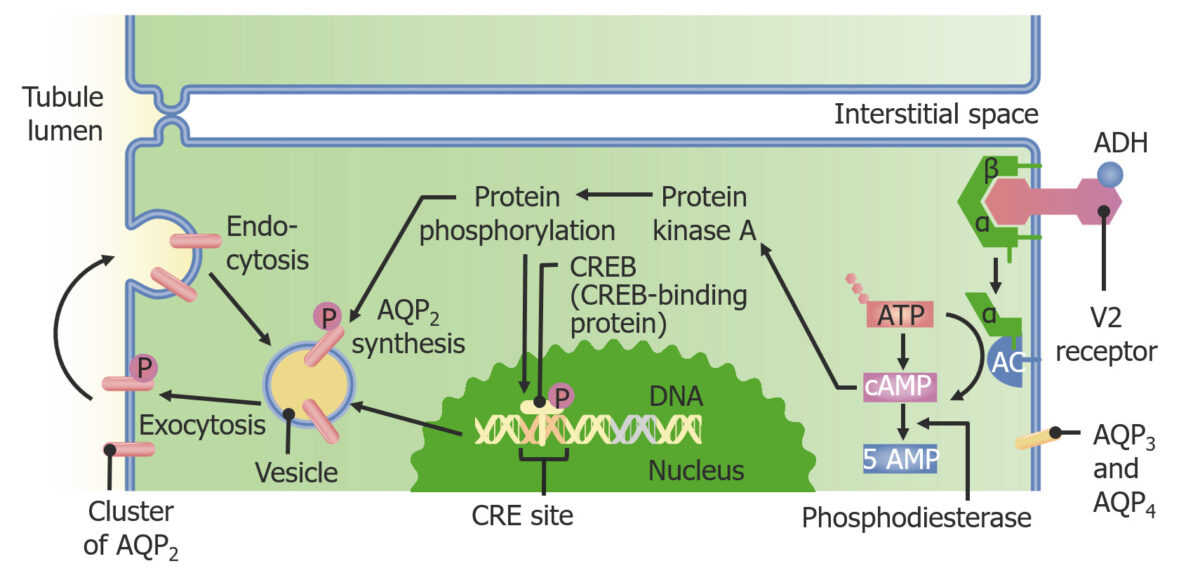
Vía del canal de acuaporina:
La hormona antidiurética se une a su receptor (V2), estimulando la adenilato ciclasa, aumentando así el AMPc e iniciando una cascada de fosforilación de proteínas que termina con un aumento de la transcripción y traducción de los canales AQP2.
La siguiente tabla resume la reabsorción, la secreción y las moléculas reguladoras importantes en todo el sistema tubular. Las moléculas reguladoras se indican entre paréntesis, y “+” y “-” indican estimulación e inhibición, respectivamente.
| Segmentos/moléculas | Túbulo proximal (túbulo contorneado proximal y PST) | Asa de Henle | Túbulo distal | Conducto colector | Excretado |
|---|---|---|---|---|---|
| Glucosa | Reabsorbida en un 98% (túbulo contorneado proximal); 2% (PST) | – | – | – | – |
| Aminoácidos y péptidos | Reabsorbidos en un 99% (túbulo contorneado proximal); 1% (PST) | – | – | – | – |
| Fosfato | 80% reabsorbido (-PTH) | – | 10% reabsorbido | – | 10% |
| Urea* | 50% reabsorbida | 30% reabsorbida; 50% secretada | – | 50% reabsorbida | 40% |
| Bicarbonato | 80% reabsorbido | 10% reabsorbido | 6% reabsorbido | 4% reabsorbido | – |
| Calcio | 65% reabsorbido | 25% reabsorbido | 8% reabsorbido (+PTH) | 1% reabsorbido | 1% |
| Magnesio | 15% reabsorbido | 70% reabsorbido | 10% reabsorbido | – | 5% |
| Potasio (ingesta dietética) | 80% reabsorbido | 10% reabsorbido |
|
|
|
| Sodio | 67% reabsorbido (+Ang-II) | 25% reabsorbido (+Ang-II) | 5% reabsorbido (+Ald, -ANP) | 3% reabsorbido (+Ald, -ANP) | 1% |
| Agua | 67% reabsorbida | 15% reabsorbida | – | 18% reabsorbida (+ADH, -ANP) | 1% |