Playlist
Show Playlist
Hide Playlist
Energy Considerations – Oxidation and Reduction in Metabolism
-
13 Basic PrinciplesOfMetabolism1.pdf
-
Biochemistry Free and Easy.pdf
-
Download Lecture Overview
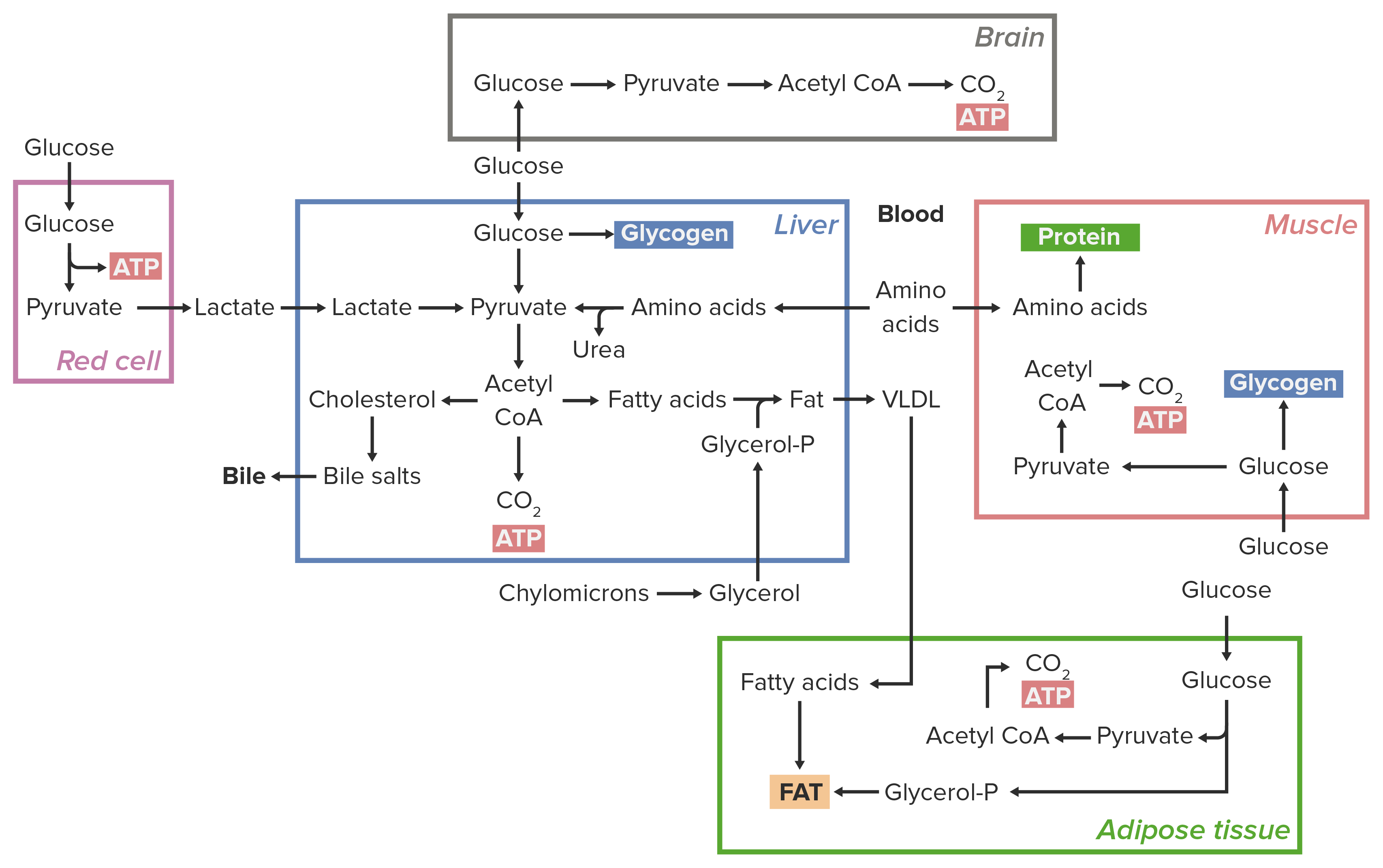
00:01 Wir leben in einer Zeit, in der der Energiebedarf für jeden sichtbar ist. Und nicht nur der Energiebedarf in der realen Welt, in der wir leben, ist wichtig. Das betrifft auch die Zellen und ihre kleinen Dimensionen. In dieser Vorlesung werde ich über den Stoffwechsel sprechen, insbesondere mit Blick auf die Energie und Oxidation und Reduktion. Zuerst werde ich in diesem Vortrag über Energie allgemein sprechen und darüber, wie sie mit Stoffwechselvorgängen zusammenhängt. 00:26 Im Anschluss daran werde ich erörtern, wie sich Oxidation und Reduktion darauf auswirken. 00:33 Wenn wir nun über Energie nachdenken, ist es sehr wichtig, daran zu denken, dass wir den Energiebedarf der Zelle irgendwie verstehen und messen können müssen. Der Energiebedarf der Zelle wird in Form von Nutzenergie gemessen und die Nutzenergie für eine Zelle ist die Gibbs-Energie (freie Enthalpie). Nun ist die freie Gibbs-Energie ein Maß für das, was verfügbar ist, um etwas nach Bedarf zu tun. Sie wird G genannt, und G ist ein sehr wichtiges Konzept, weil die Änderung der Gibbs-Energie, die Delta G genannt wird, uns sofort sagt, ob eine chemische Reaktion auftreten wird. Chemiker machen sich also Gedanken über Delta G, aber auch Biochemiker, denn biochemische und chemische Reaktionen gehorchen den gleichen universellen Gesetzen. 01:19 Das Prinzip der Gibbs-Energie hilft uns, wie gesagt, zu verstehen, ob eine Reaktion in die eine oder andere Richtung ablaufen wird und ich werde ein wenig darüber erzählen, was eine Reaktion wahrscheinlich oder unwahrscheinlich macht. Aber wenn das Delta G für eine bestimmte Reaktion einen Wert hat, der kleiner als Null ist, wird sich die Reaktion vorwärts abspielen. Wenn eine Reaktion ein Delta G hat, das gleich Null ist, befindet sich die Reaktion im Gleichgewicht und es erfolgt keine Änderung. Wenn schließlich ein Delta G für die Reaktion größer als Null ist, dann bedeutet das, dass die Reaktion rückwärts abläuft. Für Stoffwechselprozesse ist das sehr wichtig, weil diese Abbau oder Synthese einer Verbindung bedeuten können. Aber wenn man dieselbe Reaktion rückwärts laufen lässt, wird das Gegenteil davon erreicht. 02:08 Die Zellen müssen innerhalb der Energieumgebung arbeiten, in der sie existieren und wie wir sehen werden, ist die einzige Kontrolle, die Zellen über über ihre Energieumgebung haben, die Manipulation und die Konzentrationen der Edukte und Produkte für eine bestimmte Reaktion. 02:25 Für die Reaktion A, die zu B führt, können wir also schreiben, dass Delta G für diese Reaktion wie folgt lautet: Die Änderung der Gibbs-Energie, Delta G, ist gleich der Änderung der Gibbs Energie, ein Standardzustand, der gegeben ist durch die Delta-G0-Primzahl (ΔG0'), plus einem Term für die Gaskonstante, mal die Temperatur in Temperatur in Kelvin, mal dem natürlichen Logarithmus der Konzentration des Produkts, in diesem Fall B, geteilt durch die Konzentration des Eduktes A. Nun ist R, wie gesagt, die Gaskonstante und ist eine Konstante für einen bestimmten Sachverhalt, und T ist die Temperatur, gemessen in Kelvin. Nun ist ΔG0' eine Konstante für eine gegebene Reaktion, also für jede bestimmte Reaktion, die wir auswählen, die ein bestimmtes ΔG0' haben wird, aber dass ΔG0' für diese Reaktion wird nicht variabel sein, da es immer derselbe Wert ist. Wir stellen fest, dass die Gaskonstante R, auch ein konstanter Wert ist, er ist nicht zu ändern. Die Temperatur für eine biochemische Reaktion ändert sich normalerweise auch nicht, vor allem, wenn es sich um eine Reaktion handelt, die innerhalb eines thermisch regulierten Systems stattfindet etwa in einem Menschen. Das bedeutet, dass die einzigen Dinge, die das Delta G beeinflussen, die Konzentrationen der Produkte und Edukte, B und A sind. Okay. Die Erhöhung der Menge der Produkte erhöht den Wert von Delta G. Und die Erhöhung der Menge der Edukte wird den Wert von Delta G verringern, und zwar weil sich der Wert des Log-Terms ändert, entsprechend dem Verhältnis von B zu A. Je größer B wird, umso größer wird der logarithmische Term, was bedeutet, dass das Delta G größer wird. Wenn A größer wird wird der logarithmische Term kleiner, was bedeutet, dass Delta G kleiner wird. 04:08 Das ΔG0' in dieser Gleichung ist, wie gesagt, eine Konstante, und sie entspricht der Gibbs-Energie unter biologischen Standardbedingungen. 04:18 Die biologischen Bedingungen umfassen eine Temperatur von 298 K, das sind etwa 25°C und eine weitere Konzentration aller Edukte und Produkte mit Ausnahme der Protonen. Diese Protonen sind sehr wichtig, denn sie kontrollieren den pH-Wert einer Lösung und eine hohe Konzentration von vielen Protonen entspricht einem niedrigen pH-Wert und dieser niedriger pH-Wert wäre für ein biologisches System denkbar. Deshalb halten wir die Protonen in einer sehr niedrigen Konzentration für diese Betrachtung. 04:49 Unter Standardbedingungen habe ich gesagt, dass die Konzentration aller gelösten Stoffe ein Mol ist. Das bedeutet also, dass die Konzentration von B gegenüber A gleich eins ist, weil B und A am Anfang beide gleich eins sind. Das bedeutet also, dass der logarithmische Term, RT log mal die Konzentration von B geteilt durch die Konzentration von A, einen Wert von Null hat, da der natürliche Logarithmus von Eins gleich Null ist. Wenn dies der Fall ist, ist natürlich Delta G gleich ΔG0' und so habe ich die Folie begonnen, sie entspricht der Gibbs-Energie unter biologischen Standardbedingungen. Nun ist Delta G ein Wert, der sich ändern kann, je nachdem, wie sich die Bedingungen ändern. Daher wird Delta G nicht immer gleich ΔG0' sein, weil die Reaktion nicht immer unter Standardbedingungen abläuft.
About the Lecture
The lecture Energy Considerations – Oxidation and Reduction in Metabolism by Kevin Ahern, PhD is from the course Biochemistry: Basics.
Included Quiz Questions
Which of the following statements about the change of Gibbs free energy for a reaction is NOT true?
- If it is less than zero, the reaction moves backward.
- It determines the direction of a reaction.
- It is zero when a reaction is at equilibrium.
- It is related to the change in standard Gibbs free energy.
- If it is greater than zero, the reaction moves backward.
Which is true regarding a reaction for the change in Gibbs free energy?
- Increasing quantities of products will increase the value of delta G.
- The value of R varies from one reaction to another.
- Increasing quantities of products will not affect the value of delta G.
- It is negative only if the standard Gibbs free energy change is negative.
- In the human body, the value of T varies considerably.
The ΔG for a biological reaction stands for a change in which of the following?
- Free energy
- Entropy
- Activation energy
- Temperature
- Concentration of protons
Customer reviews
5,0 of 5 stars
| 5 Stars |
|
5 |
| 4 Stars |
|
0 |
| 3 Stars |
|
0 |
| 2 Stars |
|
0 |
| 1 Star |
|
0 |